

















三氯化磷是无色液体,在PCl3分子中,P原子轨道是以sp3杂化的,分子形状为三角锥,在P原子上还有一对孤电子对(见图13-6),因此,PCl3可以向金属离子配位而形成配合物,能与卤素加合生成五卤化磷。在较高温度或有催化剂存在时,可以与氧或硫反应生成三氯氧磷POCl3或三氯硫磷PSCl3。PCl3易水解生成亚磷酸和氯化氢。
PCl3+3H2O=P(OH)3+3HCl

本族的AsCl3水解产物和PCl3相似,不过水解能力稍弱些;SbCl3和BiCl3水解不完全,而NCl3的水解产物却不同于PCl3和AsCl3。NCl3的水解按下式进行:

依次类推继续进行下面反应:
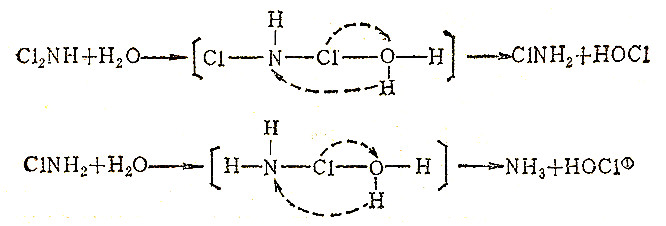
① 事实上,反应还要复杂一些,生成的NH3又被HOCl氧化为N2,故总的反应是:2NCl3+3H2O→N2+3HOCl+3Cl-+3H+
上述反应表明NCl3的水解是亲核体(如水中的氧)通过进攻Cl形成中间产物。亲核体之所以进攻Cl而不进攻N是由于:①N原子体积较小,不易受到亲核体的进攻而进攻Cl却较容易;②Cl在NCl3中有较大的电正性(按阿莱德- 罗周(Allred-Rochow)的电负性计算换算为鲍林(Pauling)的电负性标度,xN=3.07,xCl=2.83),因此,Cl的亲电能力比在正常情况下大,易接受亲核进攻。
至于PCl3的水解则是亲核体通过进攻P形成中间产物:
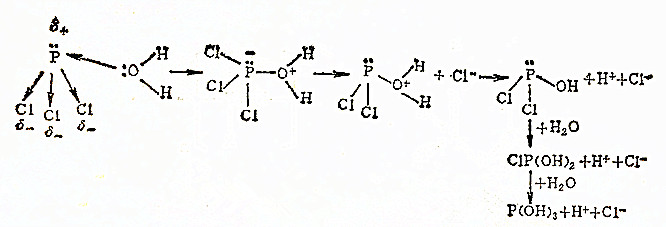
因为在PCl3中P有较大的电正性,同时过渡态中心原子P的价电子层又可以扩展,使其具有高的亲电性,这样中心原子P被亲核体进攻变得有利了。
过量氯与PCl3反应而生成PCl5,
PCl3+Cl2=PCl5
PCl5是白色固体,加热时升华(433K)并可逆地分解为PCl3和Cl2,在573K以上分解完全。

在气态和液态时,PCl5的分子结构是三角双锥,磷原子位于锥体的中央,磷原子以sp3d杂化轨道成键,见图13-7。在固态时PCl5不再保持三角双锥结构而成离子化合物,在PCl5晶体中含有正四面体的[PCl4]+和正八面体的[PCl6]-离子。

PCl5与PCl3相同,易于水解,但水量不足时,则部分水解生成三氯氧磷和氯化氢。
PCl5+H2O=POCl3+2HCl
在过量水中则完全水解,
POCl3+3H2O=H3PO4+3HCl