元素周期表是根据元素周期律,亦就是是想据元素性质的周期性变化而排成的.因此,从元素周期表,我们就可以更有系统地来认识元素性质变化的规律性,为进一步学好化学提供有利的条件.
1.同周期元素性质的递变规律在同一周期里,随着原子序数(核电荷数)的递增,元素的性质起着规律性的变化这主要表现在元素的金属性质与非金属性质的递变上.原子得失电子的难易,可以衡量元素的金属性质与非金属性质的强弱.例如,第三周期里各元素的原子核外都有三个电子层,第一,第二两层里的电子数相同,最外电子层(第层)里的电子数从钠到氯是从1个依次增加到7个.
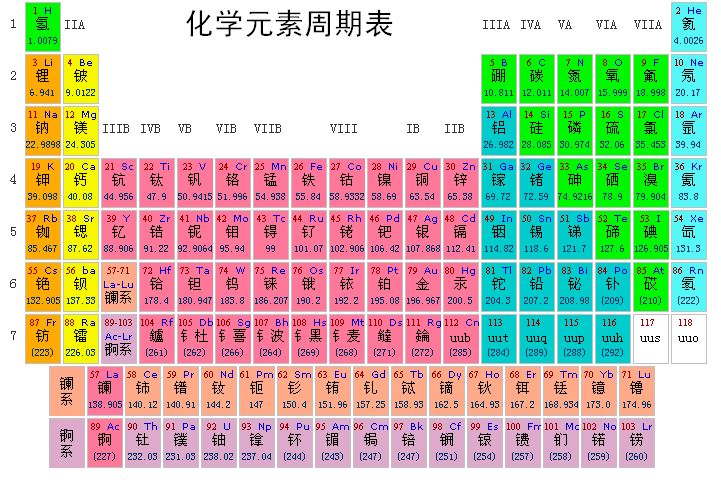
我们知道,原子核带有正电荷,电子带有负电荷,它们之间有吸引力(静电引力).如果核电荷和电子都逐步增加,那末引力亦将逐渐增强.由于在同一周期里电子层数相同,最外电子层上的电子由少而多,因此随着核电荷的增加,核对最外电子层上的电子的引力逐渐增强,使原子失去电子的倾向减小,从其他原子获得电子的倾向增大,因而表现在性质上,从表里自左向右的元素的金属性逐渐减弱弱,非金属性逐渐增强。
再有,元素的金属性越强,它的最高价氧化物的水化物的碱性也越强;元素的非金属性越强,它的最高价氧化物的水化物的酸性也越强.这样,在同一个周期里,表中自左向右元素所成的最高价氧化物的水化物的碱性逐渐减弱,酸性逐渐增强.
和短周期元素的性质递变一样,长周期元素的性质也从最强的金属性向最强的非金属性过渡,最后以惰性气体结尾但长周期中部的元素,当它们核电荷数增加时,核外电子逐个增加在次外层,而不是增加在最外层,这样,长周期里元素的金属性的减弱就比短周期慢得多,这也就是长周周期里金属元素比较多的原因,
总上所述:我们可以知道,同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强.
2.同主族元素性质的递变规律在同一主族里,随着原子序数的递增,元素的性质也有规律地变化着.我们在学习鹵族和氧族时已看到这种规律性(§1·11,§2-6),不过当时是以同主族元素的原子量递增来说明的.现在我们知道了元素的原子量的递增与原子核电荷数的递增有着密切的关系,而元素的化学性质和原子核所带核电荷数有关,所以从本质上来看,同主族元素性质变化的规律性是由元素原子核所带核电荷数的递增而引起的。
在同一主族元素里,它们最外电子层里的电子数是相同的.因此在参加化学反应时,倾向获得或失去的电子数也就相同,所以它们的化合价都相同,化学性质都相相似似.例如,卤族元素常见的化合价都是一1价,氧族元素常见的化合价都是-2价.但在同一主族里,元素的原子序数在递增,核外的电子数也在递增,虽然最外电子层上的电子数相同,但电子层数在递增,原子核对最外电子层上电子的引力就越来越弱,失去最外电子层上电子的倾向也就越来越强,而获得电子的倾向却越来越弱.这样,在同一主族里,随着原子序数的递增,在周期表里的元素,自上而下金属性递增而非金属性递减,例如卤族元素电子层数按氟、氯、溴、碘、砹的次序增加,这样获得电子的能力必然是氟最强,依次为氯、溴、碘和砹,也就是说,它们的非金属性在逐渐减弱;金属性在逐渐增强。
由于副族元素的原子结构与主族元素的原子结构有些不同,副族元素性质递变的规律,就和主族元素不完全相同,它们性质的变化情况比较复杂,这里不作介绍了。
总结以上所述,在周期表里,从左到右和从上到下各元素性质递变规律可用表3·5来表示:
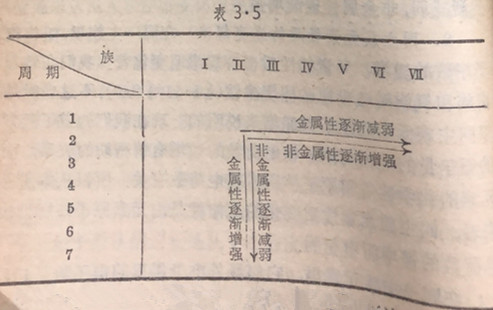
根据这种递变规律,在周期表的左边和下边排列着元素,并且越往左下方(长周期部分)金属性越强,在左下方的钫(Fr)是最活动的金属元素,周期表的右边和上边(短周期部分)排列着非金属元素(零族除外),在右上方的氟是最活动的非金属元素。
根据元素的原子结构和元素周期律的关系,我们就可以很容易地来推测某一个元素的金属性,非金属性,正负化合价,最高价氧化物的分子式和最高价氧化物的水化物的分子式以及它们的酸碱性,有无气态氢化物和气态氢化物的稳定性等.
例如,氯的原子序数为17,那末氯的原子结构简图是:
(+17) )2 )8 )7
从这个简图可以说明
(1)根据电子层数等于周期数,最外电子层上的电子数等于所属主族数,可以知道,这元素在周期表中处于第三周期,第Ⅶ主族族.并由于最外电子层上的电子数已达7个,它倾向于获得电子,所以是一个非金属元素。
(2)根据最外电子层上的电子数等于最高正化合价数,可以知道,这元素的最高正化合价为+7价,最高价氧化物的分子式是Cl2O2对应水化物的分子式为HCIO2,具酸性。
(3)这元素是第Ⅳ主族以后的元素,能生成气态氢化物.负化合价为8一7=1,故气态氢化物的分子式为HCl,稳定性较同族里上一个元素氟所成的氟化氢(HF)为差。
化学元素周期表更多介绍
化学元素周期表知识https://www.999gou.cn/article.php?id=257
元素周期律的性质与变化https://www.999gou.cn/article.php?id=256
化学同周期元素性质的递变规律https://www.999gou.cn/article.php?id=258