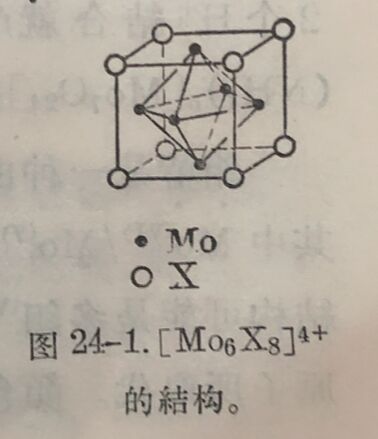鉬的化合物
铜臭 / 2022-08-08
鉬在化合物中可表現为+2到+6价,共中以六价鉬为最稳定。六价鉬的化合物中有氧化物,氟化物以及鉬酸及其盐。
二价鉬的稳定离子是[Mo₆Cl₈]⁴⁺,甚至用王水也不能将它氧化。常見的化合物有[Mo₆Cl₈]Cl₄和[Mo₆Cl₈](NO₃)₄。
三价鉬是还原剂,与Sn⁺⁺相近。只有少数化合物是已知的,如卤化钼⁽ᴵᴵᴵ⁾MoX₃(X=Br₂ Cl)。
四价鉬的化合物,如MoS₂和MoO₂,存在于自然界,此外尚有氰貉离子[Mo(CN)₃]⁻。
虽然五价鉬的卤化物,氧卤化物以及硫化物是存在的,但最有意义的是[Mo(CN)₈]³⁻,因为它非常稳定,即使使用象MnO₄⁻这样强的氧化剂,也不能将它氧化。
1.氧化物
鉬形成三个确定的氧化物MoO₂, Mo₂O;和MoO₃。
三氧化鉬是重要的氧化物。在空气中灼燒鉬或硫化钼,可以得到三氧化鉬MoO₃。
MoO₃是白色粉末,与CrO₃不同,它在水中的溶解度很小,每升水只溶1—2克;它的热稳定性較高。它的熔点为795°,沸点为1155°,即使在低于熔点的温度下,它也具有显著的升华現象,故工业上可利用升华法来提純MoO₂。
MoO₃的酸性較CrO₃为弱,但可容于NH₃水或NaOH溶液中。卸酸脱水就生成MoO₃,后者用水处理并不能生成卸酸。使乙醇和盐酸与MoO₃作用,則可生成氯化组酰或称三氯化氧钼MoOCI₃
2MoO₃+C₂H₅OH +6HCl= 2MoCl₃+ CH₂CHO+ 4H₂O
2.卤化物
兹将鉬的各种价态的卤化物汇列于表24-3内。最重要的领化物为六氟化鉬MoF₄。
表24-3 鉬的卤化物
|
氟化物 |
氯化物 |
溴化物 |
碘化物 |
|
二价
三价
四价
五价
六价
|
MoF₃
MoF₄
MoF₅
MoF₆
|
Mo₆Cl₁₂
MoCl₃
MoCl₄
MoCl₅
—
|
Mo₆Br₁₂
MoBr₃
MoBr₄
—
—
|
MoI₂
MoI₃
MoI₄
—
—
|
将鉬粉在过量氯中加热,則得墨綠色的五氯化组MoCl₅晶体(熔点194°,沸点208°)。它的分子结构是等边三角双錐体形,鉬原子位于双錐体的中心。在空气中加热,就被氧化为白色的MoO₂Cl₂
2MoCl₂+2O₂=2MoO₂Cl₂+3Cl₂
MoCI₅遇水即分解,生成称色的MoOCl₃:
MoCl₅+H₂O= MoOCl₃+2HCl
MoCl₃在氫气流中加热至250°就还原为暗红色的三氯化鉬MoCl₃。
二氯化鉬或二溴化鉬中1/3的卤素可以被AgNO₃沉淀,因此,它們的化学式可写为[Mo₂X₄]X₂。根据晶体的X射线分析表明,它們的秸构式应为[Mo₆X₈]X₄。在[Mo₆X₈]⁴⁺中,卤原子是位于立方体的八个角上,鉬原子則靠近它每个面的中心(图24-1)。[Mo₆CI₈]CI₄ 是黄色粉末,既难熔化也不揮发,几不溶于水, 但溶于酒精。它与碱作用形成[Mo₆Cl₈] (OH)₄·14H₂O。类似的溴化物[Mo₆Br₈]Br₄为橙色。
3.鉬酸和鉬酸盐
在濃的硝酸溶液中,鉬酸盐可轉化为黄色的水合鉬酸H₂[MoO₄]·H₂O而析出。逐渐加热到61°,鉬酸会脱水而变为白色的无水鉬酸H₂MoO₄。在18°时,每升水中約能溶解一克 鉬酸,溶液显强酸性。
大多数的鉬酸盐都不溶于水,只有銨、鈉、鉀、銣、鋰、鎂、鈹和鉈的盐是可溶的。其中最重要的是鉬酸鈉Na₂MoO₄ 和鉬酸銨(NH₄)₂MoO₄。
鉬酸鈉有两个水合物Na₂MoO₄·10H₂O和Na₂MoO₄·2H₂O。轉变温度为10°。当加热到100°以上时,即得无水鉬酸钠:
酸化鉬酸鈉或鉬酸銨溶液,随着溶液酸度的增高,先生成仲鉬酸根离子,继生成八鉬酸根离子,最后产生难溶的正鉬酸:
(1) 7[MnO₄] ⁻⁻+8H⁺ = [Mo₇O₂₄]⁶⁻ + 4H²O
(2) [Mo₇O₂₄]⁶⁻+[MoO₄]⁻⁻ +4H⁺= [Mo₈O₂₆]⁴⁻ +2H₂O
(3) [Mo₈O₂₆]⁴⁻+4H⁺ + 6H₂O= 8H₂MoO₄
由以上反应式可見,当每个正鉬酸根离子与1.14个H⁺相秸合时,即形成七鉬酸根离子,与15个H⁺结合則形成八鉬酸根离子,与2个H⁺秸合就产生正鉬酸。平常称七鉬酸为仲鉬酸,它的銨盐(NH₄)₆[Mo₇O₂₄]是实驗室里常用的試剂。
鉬藍是一种由五价鉬和六价鉬的鉬酸所組成的藍色化合物,其中Mo⁽ᵛᴵ⁾/Mo⁽ᵛ⁾的比例可在2.0—2.5之間变动。藍色化 合物的結构可能是多鉬⁽ᵛᴵ⁾酸分子中的一-定数目鉬⁽ᵛᴵ⁾原子的地位为鉬⁽ᵛ⁾原子所取代。顏色的发生是由于二种不同氧化态的原子之間电子转移而产生的吸收光带所引起。