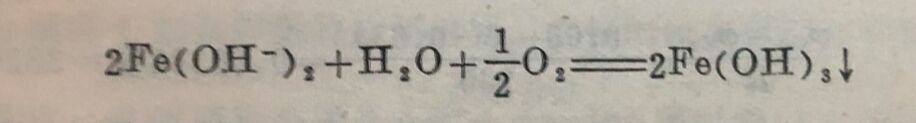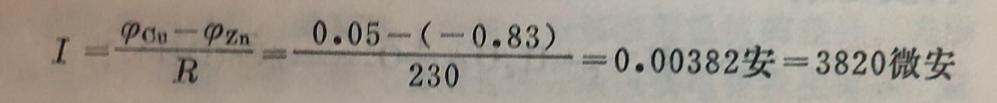一、金属的电化学腐蚀
金属的电化学腐蚀是由于在金属表面上形成的“局部原电池”所引起的。形成局部原电池而产生腐蚀的几种情况:
1.接触腐蚀。当两种金属相接触,又处于其它介质(如潮湿空气、水或电解质溶液)中时,就能发生原电池作用,结果使电极电位较小的那种金属不断溶解,从而发生腐蚀。例如,在一块锌板上有一个铜铆钉,当它们置于潮湿的空气中时,在它们的表面上将会吸附一薄层水膜。水虽然不易电离,但仍能电离出少量的H⁺和OH⁻,当水中溶有CO₂时,H⁺的数量就会增加:
CO₂+H₂O⇔H₂CO₃⇔H⁺+HCO₃⁻
而且如水中溶有其它杂质时,还会电离出其它一些离子。 因此铜锌就处在含有H⁺、OH⁻及HCO₃⁻等的溶液中,形成了锌为负极(即阳极),铜为正极(即阴极)的原电池。由于两种金属紧密接触,电池发生了短路。锌失去的电子直接流向铜,在铜上H⁺放电。这样锌便很快地遭受腐蚀:
Zn-2e=Zn²⁺
在铜上 2H⁺+2e=H₂
由此可见,金属在电解质溶液中的腐蚀是由于形成原电池所引起的。类似这样的电池我们就称之为局部原电池或腐蚀电池。这也说明了为什么大多数的腐蚀常发生在各种金属接触的地方。
还需说明,一般原电池的两个极称为正、负极,电解池的两个极则称为阴、阳极。腐蚀电池也属原电池,它的两个极习惯上把正极称阴极(起还原反应),负极称阳极(起氧化反应)。
2.微电池腐蚀。电化学腐蚀也可以发生在同种材料的金属表面上。这主要是因为金属表面上存在着电化学不均匀性而致。当金属与潮湿空气或水溶液相接触时,在金属表面上的电化学不均匀区域产生不同的电极电位,因而形成了很多局部的微小原电池.微电池。这些微电池作用时,它们阳极区的金属将不断溶解,使金属遭受腐蚀。例如碳钢在显微镜下观察时,发现它们是纯铁颗粒和碳化铁(Fe₃C,即渗碳体)颗粒和少量其它杂质所组成的。其中Fe₃C的电位较高,纯铁粒电位较低,当碳钢与潮湿空气相接触时,每一Fe₃C颗粒 (或杂质)成为阴极,纯铁成为阳极,这样在金属表面就有很多微小的阳极和阴极,形成许多微小的原电池。除金属中的杂质能造成金属表面电化学不均匀性外,金属机械加工,如锻、压、轧、延等也可引起内部应力不同以及晶体中的缺陷,都会使金属各部分的电极电位不同,而形成局部电池。一般情况是金属变形较大处的电极电位较低,易受腐蚀,例如铁板弯曲处的腐蚀。此外,金属表面温度的差异、光照的不均匀、粗糙等都会使其表面各部分的电极电位发生差异,造成产生腐蚀的条件。
3.氧的浓差腐蚀。在金属腐蚀中最有实际意义的是氧的浓差腐蚀,它是由金属与含氧量不同的溶液相接触而形成的。在第十章中已经谈过,金属浸于含有氧的溶液中会形成氧电极,并发生如下的电极反应:
O₂+2H₂O+4e=4OH⁻
氧电极的电板电位与氧的浓度有关,它们的关系可用下式表示:
可以看出,溶液中O₂的浓度愈大,氧电极电位愈高。如果溶液中O₂的含量不同,在O₂浓度较小的地方,金属的电位较低,成为阳极,在这区域的金属常常遭受腐蚀。例如在金属擦伤的地方,穴寶深处和铆钉的接触处,都因氧不易到达,而易受腐蚀,如图11-5所示。
实际上,仅仅由于一种固定的因素所图11-5 金属穴窝深处 引起的电化学腐蚀是很少见的,通常造成因氧气不均匀形成腐蚀腐蚀的局部电池总是有很多因素引起,不过可以根据具体情况,找出其中一些最主要的因素,加以解决防止腐蚀。如碳钢和生铁等在潮湿空气中的腐蚀,主要是金属表面的电化学不均匀性和空气中的水分和氧等因素共同引起的,防止腐蚀的方法,主要是使钢铁保持千燥状态。铁在潮湿空气中的腐蚀过程可解释如下:
阳极: Fe-2e=Fe²⁺
阴极: O₂+2H₂O+4e=4OH⁻
Fe²⁺和水层中的OH⁻进一步作用生成Fe(OH)₂:
Fe²⁺+2OH⁻=Fe(OH)₂↓
此过程称为二次过程,Fe(OH)₂称为二次产物。
当氧充足时:
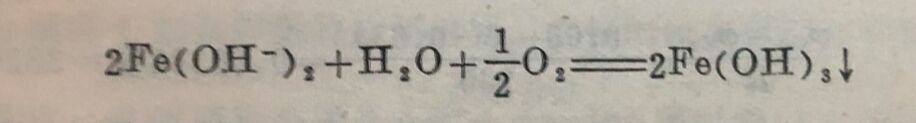
生成的Fe(OH)₂或Fe(OH)₃是一种疏松的沉淀物,覆盖在金属表面上阻碍氧气到达沉淀物下面的金属表面处。这样,沉淀物上面和下面区域的氧气浓度就不同,沉淀物下面金属处的氧气浓度较上面的小,成为阳极,此处金属遭到破坏。铁的继续腐蚀就依靠氧气的浓差来进行,往往在沉淀物下面形成明显的腐蚀坑。
二、原电池的极化作用
1.原电池的极化。原电池在产生电流时,两极的电位差小于 其电动势(E)的现象称为原电池的极化。腐蚀原电池中,阴极(正极)电位φ阴往负向偏离其理论电位φ阴,理,称为阴极极化;阳极(负极)电位φ阳往正向偏离其理论电位φ阳,理,称为阳极极化
E=φ阴,理-φ阳,理 E>φ阴-φ阳
按照欧姆定律,电流强度I与两极间的电位差(φ阴一φ阳)和电阻 (R)之间有以下关系:
式中 I一腐蚀电流强度,安;
φ阴、φ阳分别为阴、阳极电极电位,伏;
R一腐蚀系统的总电阻,欧姆。
如果电阻不变,则φ阴一φ阳减小时,I也必减小。因此腐蚀电池极化时,腐蚀电流减小,腐蚀速度也减慢,所以极化能使腐蚀减缓。
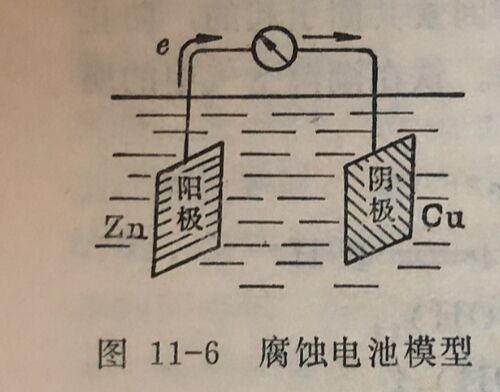
设有一个腐蚀电池为: Zn|3%NaCI溶液|Cu。如图11-6所示,Zn 为阳极,Cu 为阴极。由实验分别测得Zn电极及Cu电极的起始电极电位(没有电流通过的情况下测得的值)为φzn= 0.83伏,φcu= +0.05伏,体系中的电阻R=230欧姆。根据式 ( 11-6)可计算得电池通过的电流应为:
但实验证明,实际上电池通过的电流比计算值要小得多。如将上述电池用导线连通,则在刚接通的一瞬间,看到毫安表指示的电流值较大,在很短的时间内(几分之一秒),电流大为减小,此后在几秒钟或几分钟内,电流减小得很慢,最后达到一个稳定的值,约为200微安。此值比计算值约小19倍(这是由于φ阴一φ阳减小的结果)。
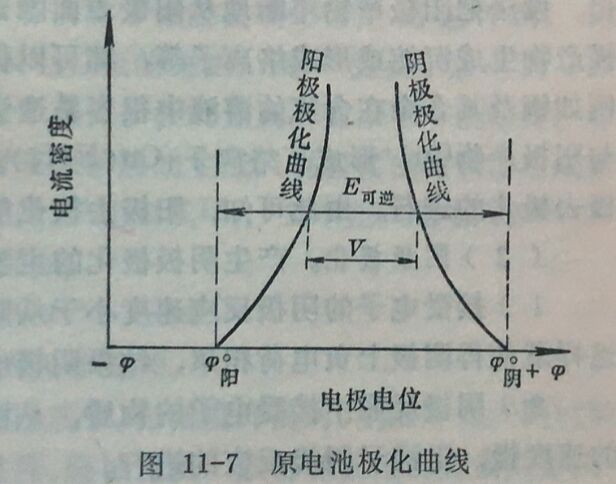
图11-7表示两极在接通电路前后,电位变化的情况。在电路接通前,即i=0时,两极间的电位差为E可逆=φ阴-φ阳;而电路接通后,阴极电位向负的方向移动,阳极电位向正的方向移动,结果使阴极与阳极之间的电位差减小{由V₀(E可造)减小到V},电池通过的电流也就减小。因此研究极化作用产生的原因及其影响因素,对于研究金属腐蚀具有重大意义。
2.阳极极化和阴
极极化:
(1)阳极极化。产生阳极极化的原因主要有以下三个方面:
1)由于阳极过程进行缓慢引起。阳极过程是金属失去电子 而溶解成金属水化离子的过程。一般说来, 金属失去的电子可以很快地由阳极传递到阴极,如果金属离子进入溶液的速度小于电子由阳极传递到阴极的速度,则在阳极上就会有过多的正电荷积累,于是阳极电极电位往正方向移动。
2)由于离子扩散过程进行缓慢引起。金属溶解时,进入溶液中的金属离子如果扩散速度不够快,会使阳极表面附近金属离子浓度升高。从能斯脱公式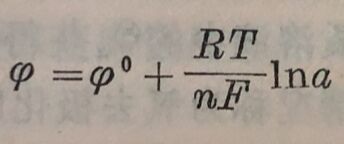 可以看出,随着金属离子浓度的增加,电极电位必然往正方向移动。
可以看出,随着金属离子浓度的增加,电极电位必然往正方向移动。
3)由于金属表面生成保护膜引起。在原电池作用的过程中,阳极上生成了一层保护膜,阳极过程受到了膜的阻碍,金属的溶解速度大为降低,结果使阳极电位剧烈地向正的方向移动。










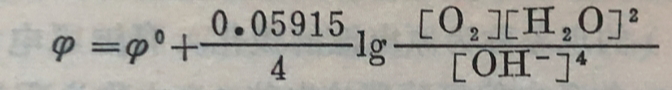
.jpg)