








迄今,我们仅考虑了由两个相同同的原子或由同元素的一个原子和一个离子所产生的分子轨道。筒要地看一下,把分子轨道理论推广应用于两种不同元素的原子间的键所涉及的一些因素,是很有意思的。
不同的元素通常有不同的电负性(参见表4-2)。这个差别反映在能级图中,因为原子轨道是以不同的能级来表示的,电负性越大的元素它的原子轨道的能级越低。
对于一个一般分子QR的分子轨道能级图表示在图5-15中。在式子中R代表电负性较高的元素。虽然也可能存在较高能量
的原子轨道,我们在这里仅考虑1s和28原子轨道。在图中没有化合的元素。元素R比元素Q有较高的电负性,如图中所
示,在能量标度中,RB的原子轨道低于Q的原子轨道把电子专门表示出来。
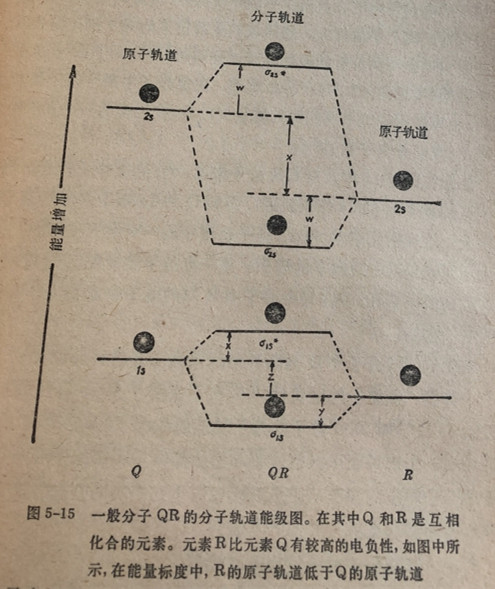
在图中的数量w和y,标志元素Q和R结合成分子QR时原子轨道间重叠的程度。重叠程度的大小同键的共价性有关系。
相互作用就越大;就是向生成更强共价键的方向发展。通常2s轨道比1s轨道离核更远,将更容易发生相互作用。因此,2o往往比y大,有如图中所示。
数量x和z同同元素Q和R的原子轨道能量差有关系,也同两个原子的电负性差值有关系。一般而言,原子轨道的能量差越大,键的极性或离子性就越大。这同我们先前讨论的关于两个结合原子的电负性差与共价键的极性以及这些键的“部分离子性”程度是有关联的(参见第47节)。有如前述,在氢分子中两个原子是相同的,相应的原子轨道有相同的能量。因此,在这样的一个共价键中极性(或部分离子性)极小。
注意在图5-15中,对QR分子来说,o1s成键分子轨道在能量上更接近于R的1s原子轨道,而和Q的1s原子轨道能量相
差较大。这表明元素R对o1s分子轨道中的一对电子的吸引力要大于元素Q对一对电子的吸引l。这一点与下述情况是一致的
R有较高的电负性,和在QR分子中R端的电子密度要大于在Q端的电子密度。
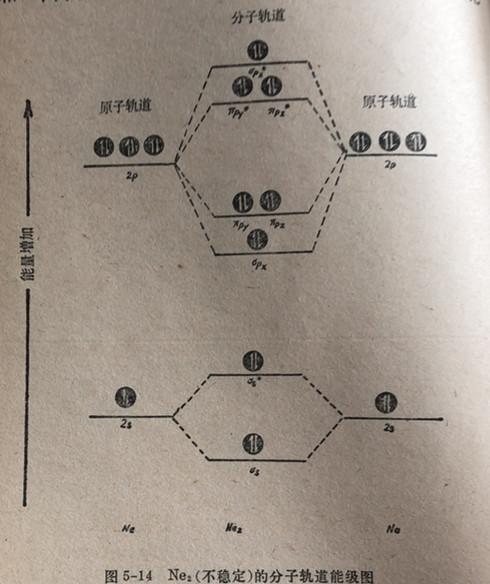
氧化氮(II)分子NO是两种不同元素所组成的双原子分子的一个特例。氧原子的电负性(35)高于氮原子的电负性(3.0)。参见表4-2。形成NO分子的分子轨道能级图,将指出在xp,反键轨道中有一个成单电子。