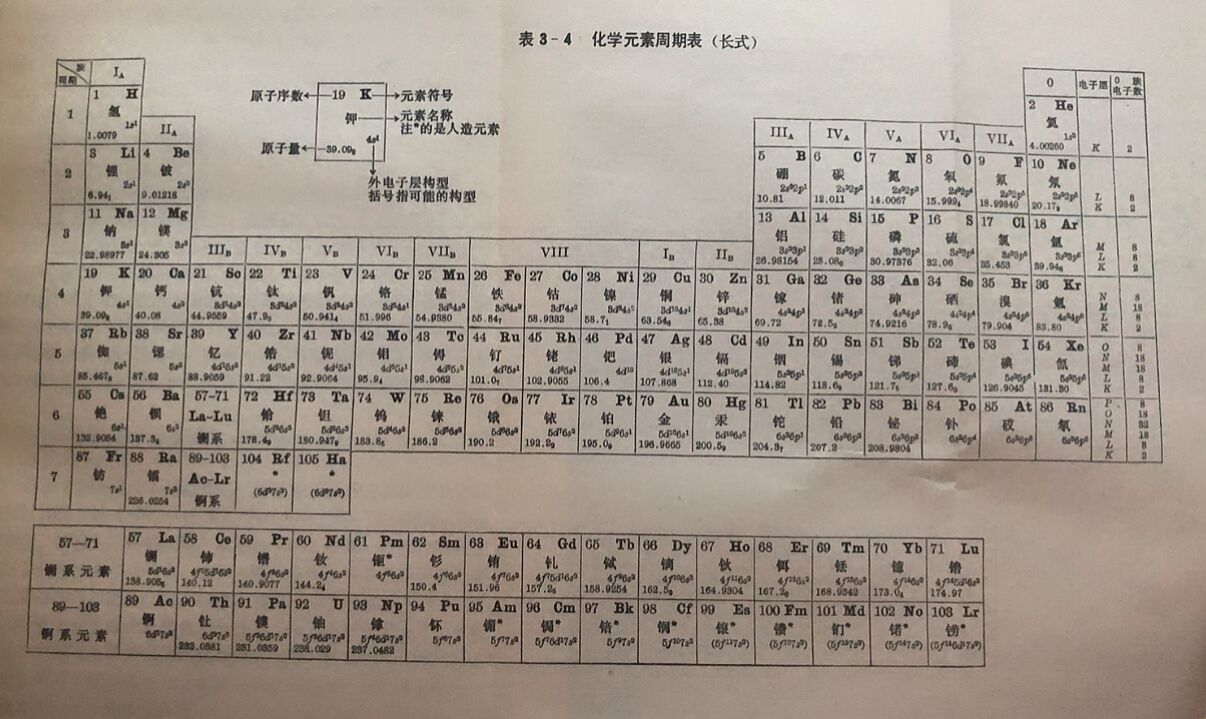
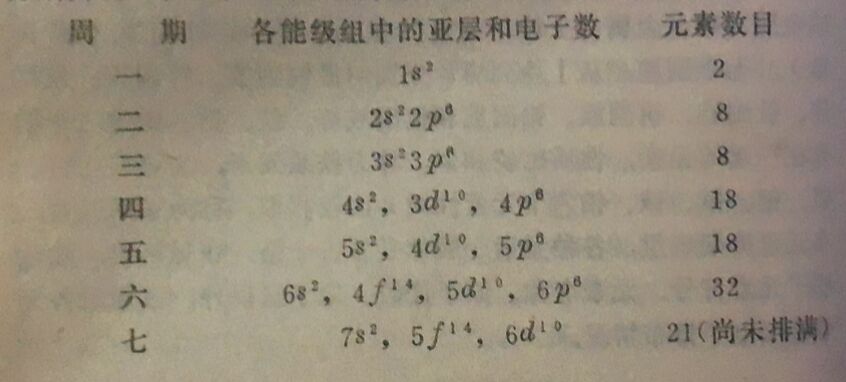1.周期。元素周期表从横的方面看,共7个横行。每一横行组成一个周期,故共有七个周期。除了第一周期从氢开始以外,其余各周期都是从最活泼的金属元素开始,到惰性元素结束。同一周期各元素的原子电子层数相同。
各个周期的元素数目是不相同的。第一周期只有 2个元素,第二周期和第三周期各有8个元素。由于这三个周期包括的元素数目比较少,所以叫做短周期。第四和第五周期各有18个元素,第六周期有32个元素,第七周期目前已经发现的有21个元素。这四个周期叫做长周期。其中第七周期尚未排满,所以它又叫做不完全周期。
在第六周期里,57号元素镧以下有14个金属元素,它们的性质与侧的化学性质非常相似,因此叫做“镧系元素”,位于周期表中同一一格内。现在只把“镧系”二字放置在原格里,而把镧及以下14个元素,排在表下面。
在第七周期里,由89号元素钢以下有14个金属元素,它们与锕的化学性质也很相似,因此叫做“锕系元素”,位于周期表中同一格内。现在只将“锕系”二字放置在原格内,而把锕及以下14个元素排在表下面。锕系元素中92号元素铀后面的元素都是用人工方法制得的,通常又把它们称为“超铀元素”。
2.族。元素周期表从纵的方面看,共有18个纵行,除第八、第九和第十这三个纵行算作一族叫做第Ⅷ族外,其它15纵行,每一纵行组成一个族。同族元素的性质相近。最右边的纵行是惰性气体叫做零族。除Ⅷ族和零族外,其它各族又分主族(用A表示)和副族(用B表示)。由短周期元素和长周期元素共同组成的族叫做主族,如铍、镁、钙、锶、钡和镭叫第二主族;只有长周期元素组成的族叫做副族,如锌、镉和汞叫第二副族。主族元素位于周期表的两端,副族元素位于周期表的中部。在各族的上端用罗马数字标出族数,数字右边用A、B表明主、副族,如ⅠA族,ⅡB族等。表里所有副族元素和第面族元素统称为过渡元素。
七个主族,习惯上又各有一个名称,从IA到ⅦA分别叫做碱金属、碱土金属、土族、碳族、氮族、氧族和卤族(或卤素)。七个副族,从IB到ⅦB分别叫做铜副族、锌副族、钪副族、钛副族、钒副族、铬副族和锰副族等。铁、钴、镍这三个横列在一起的元素,性质比较相似,称为铁系元素,为皿族。钌、铑、钯、锇、铱、铂六个元素性质又比较相似,称为铂系元素。 在元素周期表里,各种元素-般都是各占一格。在每格里,除注明了元素符号、元素名称、原子序数、原子量以外,还标出各元素外层电子排布情况。
如果沿着周期表中硼(B)到砹(At)划一条斜线,那么斜线的左下方是金属元素,右上方是非金属元素。但金属和非金属 之间并无严格的界限,位于斜线附近的元素如硅(Si)和锗(Ge )等,既有金属性,又有非金属性。
二、周期系和原子的电子层结构
元素在周期系中的位置和原子的电子层结构有着密切的联系。元素性质所以呈周期性变化,是由于当原子的核电荷数增多时,原子的外层电子周期性地重复着相似排布的缘故。因此从原子结构的观点来看,周期系中各元素的族就是根据原子核电荷数的增加和原子中电子的排布情况所作的自然分类。周期律反应了物质从量变到质变的辩证关系,同时也揭示了各种化学元素不是互相孤立而是密切相联的。
比较原子的电子层结构和周期系的关系时,我们清楚地看到以下几点:
(1)每一周期开始,都出现一个新的电子层,因此各周期中元素原子的电子层数等于周期数。如第一周期中的元素原子有 一个电子层, 第二周期中元素原子有两个电子层,余类推。例如 原子序数11的Na,它的电子排布为1s²,2s²p⁶, 3s¹。因其电子排布到第三电子层,所以它属于第三周期。
(2)各周期中元素的数目,和相应能级组中各亚层所能容纳的电子数之和相同。由于s、P、d、f亚层能够容纳的电子数分别为2、6、10、14个,所以各周期中包含的元素数如下:
(3)元素原子的电子层结构类型,决定该元素在周期表中所处的族数。主族元素的族数就是这些元素原子最外电子层上的电子数,例如卤族元素的最外层电子为ns²np⁵,所以它们都属于第Ⅶ类主族元素。当元素原子最外层充满至8个电子时(He为2个电子),这样的电子层结构最稳定,则为零类(属于惰性气体)。副族元素所处的族数等于最外层的s电子和次外层未充满的d电子的总数,例如锰副族元素的最外层电子为ns²,次外层d亚层的电子为(n-1)d⁵,两者电子的总数为7,所以它们属于第V类副族元素。而第四类元素的最外层的s电子和次外层的d电子的总数则为8~10。
(4)根据镧系和铜系元素电子层结构的特点,可解释它们在周期表的位置及它们包含的元素数目。因这些元素最外的三个电子层(即最外层、次外层和外数第三层)都未排满,它们最外层和次外层的电子数基本相同,只是从外向里数第三电子层中f亚层的电子数不同,这对元素的性质影响很小,所以它们的化学性质非常相似。又因f亚层有7个轨道,共可容纳14个电子,因此镧系和锕系各有14个元素。镧系元素的性质与镧相似,钢系元素的性质与锕相似。因此把它们分别合在镧和锕两元素的位置上。
























![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)