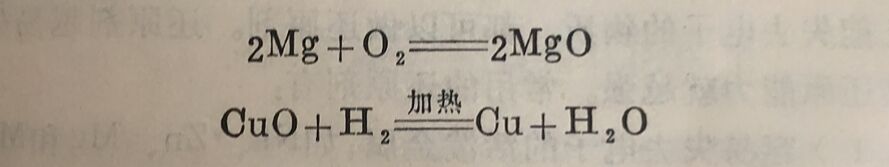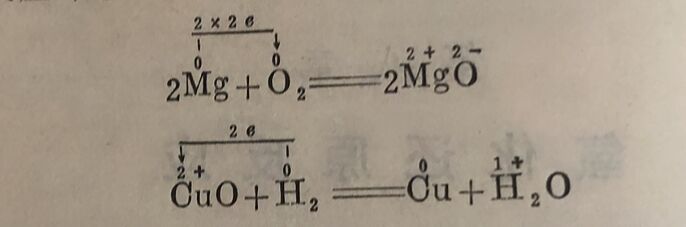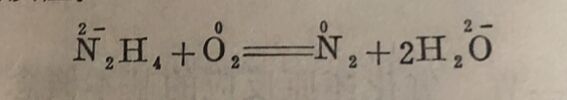氧化还原反应的基本概念
铜臭 / 2022-07-22
氧化还原反应最初的含义是指物质与氧化合和从化合物中夺取氧的反应。例如镁的氧化反应和氢气还原氧化铜的反应:
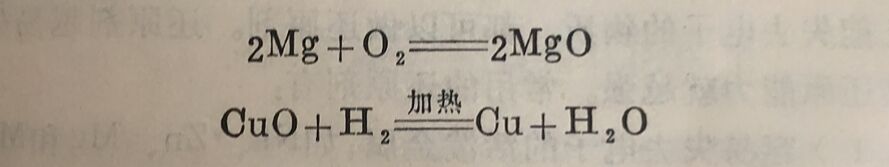
广义的氧化还原反应是指反应物元素氧化值发生改变的反应。氧化还原反应中元素氧化值改变的实质是反应物之间发生了电子的转移。某元素失去电子,氧化值升高,这个过程称为氧化;另一元素得到电子,则氧化值降低,这个过程称为还原。因此,上述反应可以进一步用电子得失来说明:在上述第一个反应 中,镁元素由于失去两个电子,氧化值就由0升到+2,镁被氧 化;而氧元素由于得到两个电子,氧化值就由0降到-2,氧被还原。反应中发生了电子得失,电子由镁向氧转移。在第二个反应式中,氢元素失去了一个电子,氧化值由0升到+1,氢被氧 化;而铜元素得到两个电子,氧化值由+2降到0,铜离子被还原,在反应时电子由H₂向Cu²⁺转移。即
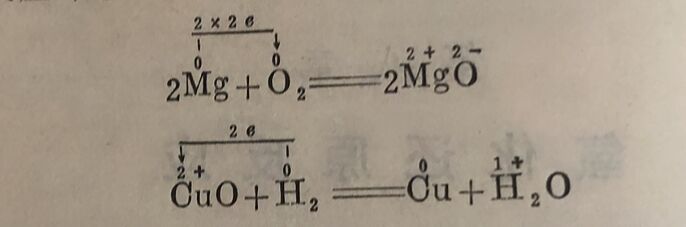
氧化与还原过程必然是同时发生的。在反应中,一物质失去 电子,必须同时使另一物质获得电子, 也就是说有氧化值升高的物质,必同时使另一物质的氧化值降低。这种本身被氧化而使另一物质还原的物质,称为还原剂。同样,得到电子的物质(即氧化值降低),必同时使另一物质失去电子(氧化值升高)。这种本身被还原而使另-物质氧化的物质,称为氧化剂。例如联氨与水中溶解氧的反应:
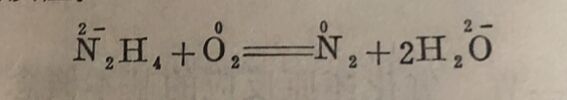
氧元素(O₂)得到电子,氧化值由0降到-2,故O₂是氧化剂;N₂H₄中的氦元素(N)失去电子,氧化值由-2升高到0,故N₂H₄是还原剂。
凡能失去电子的物质,都可以做还原剂。还原剂越易失去电子,其还原能力就越强。常用的还原剂有:
(1)容易失去电子的活泼金属,如Na、Zn、Mg和Mn等;
(2)低价的金属离子,如Sn²⁺和Fe²⁺等;
(3)低价或较低价的含氧化合物,如SO₂、H₂C₂O₄、Na₂SO₃和CO等。
凡能接受电子的物质,都可以作氧化剂。氧化剂越容易接受电子,其氧化能力就越强。常用的氧化剂有:
(1)容易获得电子的非金属单质,如CI₂、 Br₂、O₂和O₃等;
(2)高价的金属离子,如Fe³⁺、 Sn⁴⁺和Cu²⁺等;
(3)高价或较高价的含氧化合物,如MnO₂、 KMnO₄、K₂Cr₂O₇、KCIO₃、 H₂O₂、HNO₃和HCIO₄等。
某元素形成各种不同氧化值的化合物时,具有最高氧化值的化合物可用作氧化剂;具有最低氧化值的化合物可以用作还原剂;介于最高和最低氧化值之间的化合物,根据反应的具体条件既可作氧化剂,又可作还原剂。例如H₂O₂中氧的氧化值为1, 介于氧的最高氧化值(0)和最低氧化值(-2)之间,所以它既可作为氧化剂也可作为还原剂,但一般主要是用作氧化剂。例如H₂O₂在下列反应中:
H₂O₂+2HI=I₂+2H₂O
H₂O₂+Cl₂=2HCl+O₂↑
前一反应的H₂O₂作为氧化剂(氧的氧化值从-1→- 2), 后 一反应的H₂O₂作为还原剂(氧的氧化值从-1→0)。 这是因为HI是较强的还原剂,Cl₂是较强的氧化剂,当H₂O₂与较强的还原剂作用时,显氧化性,和较强的氧化剂作用时,叉显还原性。此外,反应条件——如浓度、温度和溶液的酸、碱性等,也会影响氧化剂和还原剂的氧化还原能力。关于氧化还原能力的大小,将在原电池一章中讨论。












































![2,2-双[4-(4-氨基苯氧基苯)]六氟丙烷](images/202103/thumb_img/3458_thumb_G_1615773264954.jpg)