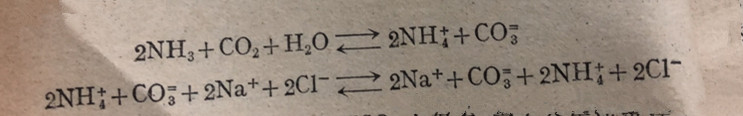工业上生产碳酸销(纯碱)大都采用“氨碱法”①.现在我们把这个方法的化学原理、设备、生产过程和优缺点等分段讲述于下:
化学原理 从碳酸钠的分子式Na2CO3来看,它是由钠离子和碳酸根离子组成的电解质,因此,制取它最理想的方法是,用两种能提供这些离子的物质为原料,经复分解反应而得到,食盐(NaCI)和石灰石(CaCO3)似乎是符合上述要求的最便宜的原料,但是,石灰石不辩于水,不能和食盐直接发生复分解反应生成碳酸钠,事实上,自然界里也没有其他可溶性的碳酸盐可作为原料的。因此必须先制成一种“中间产物”作为过渡,反应原理是这样的:
(1)把石灰石在高温下煅烧,分解得到二氧化碳的生石
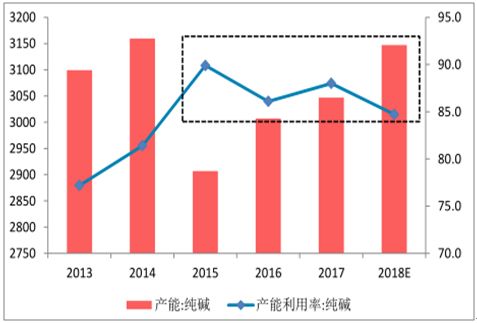
(2)把二氧化碳通入他和的氮水中,使生成碳酸氢铵的溶液: (3)碳酸氢铁溶液跟食盐辩液起复分解反应,产生碳酸氢钠沉淀作为一个中间产物: (4)然后,把溶液过滤得到碳酸氢钠固体,再在高温下双烧,分解成碳酸钠: ①这个生产方法是比利时工程师苏尔维于1861年首先提出的,所以也叫苏尔维法。 实际上,反应(2)和(3)是在同一一榕液中连续进行的,它们是一组连续的可逆反应,NaHCO,成沉淀析出是使这两个可逆反应的平衡向前移动的原因,也是氢碱法成功的关键。以必须选择和采用有利于形成NaHCO3沉淀的条件和措施。 首先,我们注意到温度:降低温度有利于CO3气体和氨气的溶解,从而增加反应物的浓度,也就促使形成NH4HCO3的平衡向前移动,同时也就接着有利于反应(3)的形成NaHCO3的平衡的向前移动。当然在反应(3)中 NaHCO3本身的溶解度也因温度降低而变小,使它容易从溶液中析出,结果亦使反应(3)的平衡向前移动,从而影响反应(2)的平衡也向前移动,但是,温度降低也会影响反应(3)中的其他盐类的容解度下降,所以我们应该选择适当的温度,在这个温度下,既使NaHCO3的辩解度较小,而且和其他盐类的容解度比较,差别又较大,这样,就有利于NaHCO3的沉淀分离。实用上,一般选择30-35C的温度. 其次,我们再来研究溶液的浓度问题,我们知道,反应物的浓度越大,平衡越向前移动,所以原则上,应设法使溶液对各种溶质来说都达饱和的程度。但是,我们也应注意到CO2和NH,的量的比数关系。如果NH,过量,反应就不是如(2)那样,而是: 这里Na2CO3的溶解度较NaHCO3大得多,它不会生成沉淀,反应最后达到平衡而不再前进了,因此,必须使用过景CO,使溶液中形成HCO;根离子,而不是形成CO;根离子,这是这个方法的成功的重要关键所在实用上,先在他和食盐水客液中通入氨气达饱和,然后降温到30~35*C再通入过量的CO气体,以完成反应(2)和(3). 此外,我们再来谈谈氨在反应过程中的作用问题,从反应(2)和(3)来看,NH3变成了NH4C1.如果把过滤除去NaHCO3沉淀后的母液加入石灰乳[Ca(OH)2]就能发生下列反应而重新得到NH3:: 这样得到的氨又可重复使用,在理论上没有损耗。 当然,在实用上,氨是或多或少要损耗一些的,所以需要随时补充,补充用的和过程开始时所需要的适量氨,一般是用铵盐[例如NH4C1, (NH4)2SO4等]跟石灰乳反应而制得。当然也可用氮水或液态氨,至于石灰乳的来源也是本工业所现成的,就是反应(1)的另一种产物CaO跟水反应而得: CaO+H2O= Ca(OH)2 到此,我们可以概括起来说:生产纯碱的原料是食盐(NaCI)和石灰石(CaCO3);产品除纯碱(Na2CO3)外, 还有一种氯化钙(CaC12), 它是原料中的另外两种离子所组成的物质,由于原料不能直接反应,所以需娶利用氦的作用,在一定条件下,通过一系列的反应过程才能制得纯碱。过程中生成的碳酸氢钠是一种中间产物,它的形成沉淀析出是这个方法成功的关键。 工业生产过程 根据上述的基本原理,工业上用级碱法生产纯破时,主要分成两个阶段: (1)制成碳陂氢的; (2)煅绕中间产物制成纯碱。 1.碳酸氢钠的生成 先用系把提纯的饱和食盐溶液提升到高位槽储存,从那里再自动地流入吸复塔。当饱和食盐接液从吸氨塔顶上淋下时,把干燥的氨气由塔底通入,这样用地流原理让氦气溶解在食盐溶液中达饱和程度。当氦溶解于水时,放出热量,溶液的温度升高,不利于氨气的溶解(气体溶解度跟温度成反比),因此在吸氨塔底部有冷却装置,能把溶液冷却到25C左右,在吸复塔里,一小部分氨气跟水反应,生成氢氧化铵,而大部分每气以溶解形式存在。 从吸氨塔底部出来的溶液称作红化盐水, 用泵移到碳酸塔的顶部,从那里淋下来,同时从塔底通入过量二氧化碳,在塔里进行反应,开始,氨气、水跟二氧化碳反应生成碳酸氢铵,由于这个反应放热会使溶液温度升高,因此碳酸塔下部也有冷却装置,使温度稳定在30~35C间,这时碳酸氢铵立即跟氯化钠反应,成碳酸氢钠晶体析出,原理中的反应(2)和(3)合并成: 从碳酸塔底部流出的悬浮有碳酸领销品体的溶液,送入过滤机中进行分离,得到的品体就是碳酸银销;母被里含有氯化铵和没有起反应的氧化钠(约为原料的30%). 2.煅烧碳酸氢钠使分解生成碳酸钠从过滤机得到的碳酸区纳晶体送入转炉里加热煅烧.炉子不断地转动,翻动晶体,这样可防止加热不均勾而发生粘结现象.碳酸氢钠慢慢分解生成碳酸钠,分解时放出的二氧化碳可再通入碳酸塔循环使用, 氨碱法的优缺点 这个方法的优点是原料(食盐和石灰石)成本低,产品碳酸钠的纯度高(杂质大部在母液里),如气和部分二氧化碳可循环使用,制造步骤简单,适合于大规桃生产,但它也有若千缺点:最大的缺点是没有充分利用物资,在两种主要原料里,只利用了食盐中的钠离子和石灰石中的碳酸根离子,而全部氯离子和钙离子没有利用,它们结合成氣化钙处理这样得到的含杂质很多的氯化钙稀溶液就成为征大负担,因为要提纯它是很困难的,实际用途也不大,如果把大量氯化钙排入河流中,会影响鱼类的生存和繁殖;如把它堆放起来,不仅占地很大,而且氧化钙有吸湿性,堆放的地方将成为泥泞不千的废墟。并且,食盐的利用率也很低,只有70%转化,30%随CaCl溶液损失了。此外在母液里含有大量氯化铵设有完全被回收,即使从回收的部分来看也并不很合理、我们知道,氯化铵是一种很好的氮肥(第二册5.8),它比硫酸铁(俗称肥田粉)的肥效还要高,不会增加土壤的酸性,现在却把已经制成的氮肥回收成每气,这样的生产是不合理的。 我国的科学家和工人,经过多年的苦心研究,创立了联合制碱法,它应用了复碱法的优点,克服了氨碱法的缺点,不仅充分利用了物资,而且同时得到两种产品----纯碱和氯化铵. 联合制碱法的基本原理 在制纯碱部分和氨碱法相同,主要区别是氨的来源不同,它不是从氧化铵回收氨气,而由合成氨厂直接供给,这里合成氨所需要的氮气和氢(是从发生炉煤气和水煤气制取: 同时又有大量二氧化碳生成,可以供给制破法作原料,这样就不需要用石灰石作原料来制取二氧化碳,因此降低了制纯碱的成本,也简化了操作过程,方法中又设法让母液里的氧化按结晶出来,把晶体分离就是氮肥,于是母液还剩下氧化的可循环使用,这样可以充分利用物质。 最后附一张纯碱利用率走势图。
.jpg)