







氧化还原反应在分析化验工作中用的也很多。常用的氧化剂有:重铬酸钾、高锰酸钾、铁氰化钾、碘、碘酸钾、溴酸钾、硫酸铈等;常用的还原剂有:硫酸亚铁、硫代硫酸钠、亚砷酸钠、草酸、硫酸亚铁铵、氯化亚锡等。
上述氧化剂与还原剂两两相搭配如下:
重铬酸钾与亚铁盐;高锰酸钾与亚铁盐;或高锰酸钠与草酸钠;碘与硫代硫酸钠;硫酸铈与硫酸亚铁;次氯酸钠与亚砷酸钠。
氧化和还原是事物矛盾的两个方面,它们既是对立的又是统一的,彼此都不能脱离对方而孤立存在。就是说,一种物质的氧化,必定同时伴随着另一种物质的还原。因为在氧化还原反应中,所谓氧化是指原子或离子丢失电子(原子价增高)的化学过程。例如:
2Br--2e ⇋Br2
而还原则是指原子成离子获得电子(原子价降低)的化学过程。例如:
Cl2+2e ⇋2Cl-
但是,在氧化还原反应中,电子不会平空而来,也不会运停在游离状态,只能从某些原子成离子转到另一些离子或原子。所以,上述两个过程应统一为:
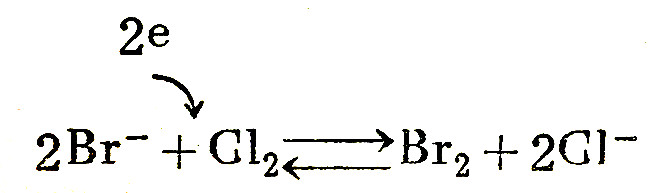
在氧化还原过程中、能使其它物质氧化而本身被还原的物质则做氧化剂.如上例中的氯分子;而能使其它物质还原本身被氧化的物质叫做还原剂,如上例中的溴离子。
氧化剂和还原剂当量的确定,需看其在化学反应过程中的电子得失数。
现将比较常用的还原剂硫代硫酸钠的标准溶液的制备和标定方法作一讨论,借以熟悉这一类标准溶液的制备和标定方法。这一标定方法实际也属于碘量法的分析工作中的一例。硫代硫酸钠的是还原剂在化学反应过程中被氧化剂碘氧化了,也可以说氧化剂碘被硫代硫酸钠还原了。
.jpg)
氧化剂碘,往柱不是用纯碘加到硫代硫酸钠溶液中去,而是从碘化物中用氧化剂把碘化物中的碘氧化出来,再与硫代硫酸钠作用、这是由于纯碘在空气中容易挥发(升华),其量不好控制。这个反应过程是这样的:
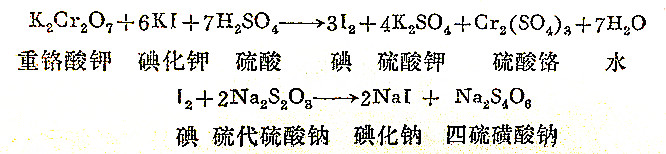
在上述反应过程中,K2Cr2O7中的铬(Cr6+)为正6价,变为Cr2(SO4)3时,成为三价的铬离子,即每个Cr6+获得3个电子,共有两个铬(Cr6+)在其中参加反应,所以K2Cr2O7的氧化当量为其分子量的1/6。故重铬酸钾的当量应为:
K2Cr2O7/6=294.19/6=49.03
Na2S2O3在反应前S为正2价,反应后为Na2S4O6中的S是2 1/2价,对一个Na2S2O3分子来说,其中有两个S,所以Na2S2O3的还原当量为2×1/2=1。硫代硫酸钠是带有5个结晶水(Na2S2O3·5H2O)的固体,一般都含有少量的杂质(如硫、亚硫酸钠、硫酸钠、氯化钠等),而且易风化失水,称量不易达谁确要求。所以只能配成近似浓度,再用重铬酸钾作基准物质进行标定,终点以淀粉溶液作指示剂。
例如,要配制0.2000N近似浓度的Na2S2O3溶液1000毫升(Na2S2O3·5H2O=248.18)。
应称取 Na2S2O3·5H2O的重量:
W=248.18×0.2×1=49.64克
在托盘天平上称取49~50克Na2S2O3·5H2O加水溶解并冲至1000毫升,待静置1周后标定(如果需现标定,可用煮沸驱除水中溶解的CO2)。
配制基准物质K2Cr2O7的标准溶液:经105℃烘干的K2Cr2O7称取量为:
W=294.19/6×0.2×100/1000=9.8克
在托盘天平上称取K2Cr2O7 9~10克,又在分析天平上精确称重,假设为9.8505克,溶解后冲至100毫升,其精确浓度为:
9.8505/(49.03×0.1)=0.2010N

标定与计算:
取0.2010N K2Cr2O7溶液20亳升于三角瓶中,加10%KI10毫升,4N H2SO4溶液5毫升,摇动均匀,静3分钟,用近似0.2000N待标定的硫代硫酸钠溶液滴定到淡黄色时,加新配1%淀粉指示剂3毫升,再继续滴定到蓝色消失。假设用Na2S2O3溶液为20.25,则根据NV=N'V'公式计算出硫代硫酸钠溶液的精确浓度应为:
0.2010×20/20.25=0.1990N
注:① 配制Na2S2O3标准溶液需用无CO2的蒸馏水,即将蒸馏水加热煮沸30分钟以上,冷却后使用。如有CO2存在时,Na2S2O3易被分解,Na2S2O3+H2CO3→NaHCO3+NaHSO3+S↓。
② 淀粉指示剂需用新配制的。配法:1克淀粉用少量水调和均匀,将100毫升蒸馏水煮沸后,边加淀粉糊边搅拌,再沸即可。应澄清透明。
③ Na2S2O3易被空气氧化:2Na2S2O3+O2→2Na2SO4+2S↓;也易被微生物分解;日光能也能促进Na2S2O3分解。所以Na2S2O3溶液应尽量避免和空气接触,并贮存在有色瓶中。在新配制的Na2S2O3溶液中,可加入数滴氯仿或少量碘化汞(10毫克/升)防止微生物的分解。
④ 配成的Na2S2O3溶液,其浓度随时间稍有改变,在最初10天内,常常有些增加;此后浓度就慢慢减小。所以新配制好后,须静置1周稳定后再标定。如长期保存需要每隔半~1月重新标定一次。如时间太久,或保存不当,溶液中析出大量的硫,溶液呈现浑浊,即需重新配制。
