



指示剂是一种弱酸或弱碱,而且未离解的分子与其离子有不同的颜色。例如,石蕊指示剂是一种弱酸,未离解的分子是红色的,而它的阴离子则呈蓝色。当平衡时用方程式表示,则:
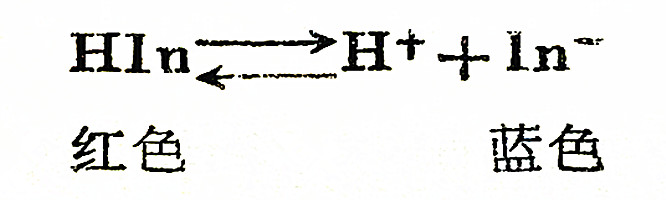
当石蕊溶于水时,它未离解的分子HIn与其离子In-同时存在于溶液中,使溶液中呈现出过渡的颜色,即紫色。这时,如果加入某一种酸于溶液中,即打破上式的平衡,使反应向左方移动。因为加入的氢离子将溶液中的In-大部分化合成不离解的分子HIn,又建立新的平衡。这时未离解的HIn分子比原水溶液中的平衡式中的HIn分子增加了很多,相应地In-大量减少。溶液中即显出未离解分子HIn的红色。
相反的,如果将某一种碱(如NaOH)加入石蕊水溶液中,则碱中的OH-便与指示剂的H+化合生成不离解的水分子(H2O),使反应向右方移动,促使溶液中大量地增多了In-。因而溶液中就显出蓝色。
指示剂变色时所发生的现象较为复杂。实际上,指示剂未离解分子本身离解成离子或离子再变为不离解的分子时,是由于它们在结构上的改变才引起颜色的改变。即未离解分子的结构不同于其离子形式的结构,所以它们的颜色就不相同。以酚酞为例,其变化时的结构改变形式是:
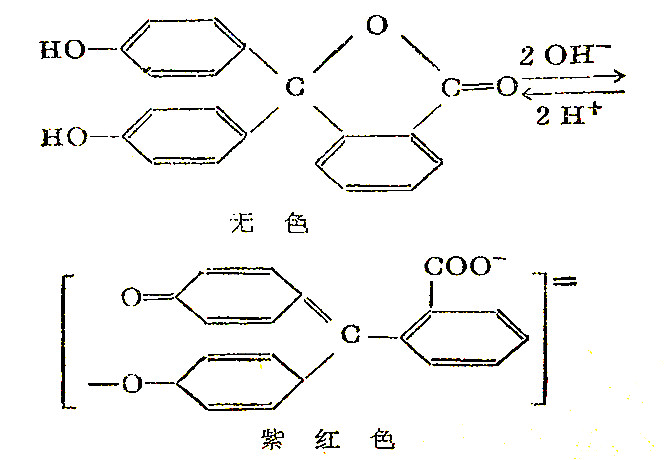
当加酸或碱于指示剂的溶液中,就会改变溶液的pH值,指示剂的结构能够改变而变色,就是与pH有关。
例如,加1~2滴甲基橙于碱溶液中,用酸逐滴地进行滴定。碱溶液的浓度虽然逐渐地降低,而且溶液的pH值逐渐减小,但溶液的颜色却与加酸以前一样仍然是黄色。当全部碱被中和而溶液的pH等于7时,对溶液的颜色仍然没有丝毫影响。继续滴入过量的酸,使溶液的pH小于7,起初对颜色仍无影响,但当滴定至pH等于4.4时,即从这一瞬间开始,pH值越小就越使溶液变为明显的玫瑰红色。当滴定至pH值等于3.1时,溶液变为鲜艳的玫瑰红色。以后,无论再滴加多少酸,颜色也不再加深或改变。由此可见,当pH>4.4时,甲基橙呈黄色,当PH<3.1时,甲基橙呈玫瑰红色。它的颜色从pH=4.4至PH=3.1的范围内,逐渐从黄色变为玫瑰红色。所以,每一个pH值都相当于一定的颜色。以上所述,可用图6-1所示。
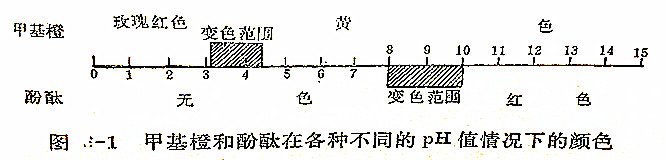
能使某种指示剂变色的pH值的范围,就称为该指示剂的变色范围。各种指示剂的变色范围都有其自己的一定pH值范围。如上图解中的酚酞指示剂,其变色范围是从pH=8到pH=10。即当pH<8时,它是无色的,当PH>10时便呈鲜红色。
用于酸碱滴定的各种指示剂的变色范围是由于各种指示剂的电离常数大小不同而其变色范围也就不同。对同一类的指示剂来说,电离常数大的(即较易离解的)指示剂,在pH值较小时变色;反之,电离常数小的指示剂,在pH值较大时变色。例如,甲基橙的电离常数(K≈10(-4次方))就比酚酞的电离常数(K≈10(-9次方))大得多,从上图解中可以看出,它们的变色范围显著不一样。甲基橙的变色范围在pH3.1~4.4,而酚酞在pH8~10。一般地说,指示剂的变色范围不大于2个pH值单位,也不小于1个pH值单位。