





前面文章学习了热分解法、热还原法等提炼金属的方法。现在我们用△G°来判断某一金属从其化合物中还原出来的难易及还原剂的选择等问题。
金属氧化物越稳定,则还原成金属就越困难,各种不同金属氧化物还原的难易,定量地比较它们的生成自由能就可以知道,氧化物的生成自由能越负的,则该氧化物越稳定,而金属就越难被还原。
艾林汉(Ellingham)在1944年首先将氧化物的标准生成自由能对温度作图,后又对硫化物、氯化物、氟化物等作类似的图。这种图称为自由能图(也称为艾林汉图)。用这种图可以在任何一类化合物中,立即看出哪些金属较其它金属能生成更稳定的化合物;因而可以比较直观地从图上判断一个金属还原过程在高温时能否进行,以及这个过程倾向的大小,故在冶金上有重要的应用。
图16-2是用消耗1molO2生成氧化物过程的自由能变化对温度作图的。根据
△G°=△H°-T△S°
的关系,只要△S°不等于零,则△G°将随温度的改变而改变。假如△H°和△S°为定值,则△G°对绝对温度作图便得到一直线。直线的斜率等于反应的熵变。在0K时,△G°=△H°,此时直线与纵坐标的截距即为△H°的近似值。只要反应物或生成物不发生相变(熔化、气化、相转变)△G°对T作图都是直线。因为如有相变,必定有熵变,由于熵变是直线的斜率,所以当发生相变时,直线斜率将会改变。
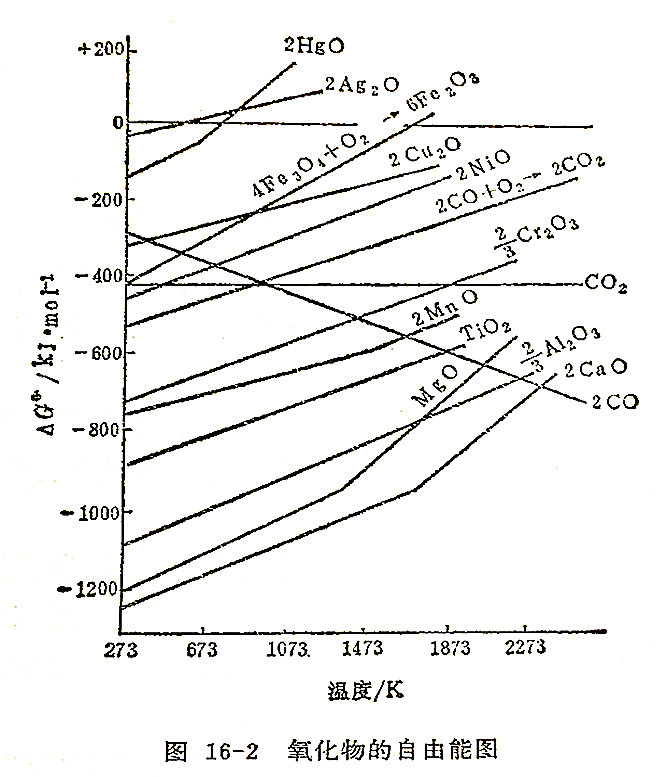
从图16-2的氧化物自由能图可以得到一些金属还原过程的规律:
1.一个反应要能进行,其△G°必须为负值,从图可看出,凡△G°为负值区域内的所有金属都能自动被氯气氧化,凡在这个区城以上的金属则不能,例如银。某些金属随着温度的升高,△G°负值减小,当直线与△G°=0的水平线相交越过这一水平线时,表明△G°≧0,这意味着超过这个反应温度时,氧化不能自发进行。在△G°≧0的区域内氧化物是不稳定的,会自发分解。例如反应:
4Fe3O4+O2=6Fe2O3
在1773K以上Fe3O4不可能氧化,因为在1773K以上Fe2O3是不稳定的。由图可知约在773K以上Hg就不可能氧化,而HgO只能稍微加热,超过773K就可以分解得到金属。
2.氧化物的稳定性和其△G°值大小直接有关,稳定性差的氧化物△G°负值小,△G°-T直线位于图上方,例如Ag2O、HgO。稳定性高的氧化物△G°负值大,△G°-T直线位于图下方,如MgO、CaO。在自由能图中,一种氧化物能被位于其下面的那些金属所还原,因为这个反应的△G°<0。例如在1073K时,Cr2O3能被Al还原,而Al2O3就不能被Cr还原。
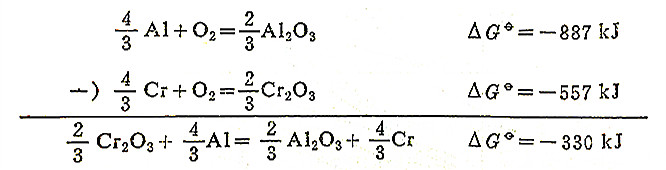
3.图中C+O2=CO2的直线几乎是水平的,即其斜率≈0,这个反应实际上没有熵变。因反应开始和终了气体分子数不变。固体熵变可以忽略。
反应2C(s)+O2(g)=2CO(g)的直线向下倾斜,即具有负的斜率。这是因为1体积的O2生成了2体积的CO,气体分子数增加,熵增加很大,故温度升高,△G°变得更负。
反应2CO+O2=2CO2的直线因变为负值,所以温度越高,反应的△G°增大,直线从左向右向上倾斜。三直线交于983K。高于此温度,2C+O2=2CO的反应倾向大,低于此温度,2CO+O2=2CO2的反应倾向更大。
生成CO的直线向下倾斜对于火法冶金有很大实际意义,这使得几乎所有金属的△G°-T直线在高温下都能与C-CO直线相交。这表明许多金属氧化物在高温下能够被碳还原,使碳成为一种广泛应用的优良的还原剂。在2273K以上,理论上碳可以还原Al2O3,但由于所需温度太高,目前还没有耐这样高温的炉壁,而且反应还会生成碳化物,而使这个过程的实用性受到限制。最后须注意,用△G°判断氧化还原反应的自发方向是在平衡条件下,并不涉及反应速度和机理,在实际生产中,往往很复杂,需要全面的、具体的分析,才能得到正确的结论。