许多非金属和过渡金属元素都能以数种氧化态存在,而且同一元素的各种氧化态的氧化性有很大差别,一般说来,它们的氧化性随着氧化值的升高而增强。如果同一元素不同氧化态的氧化还原性的相对强弱能借助于直观的方法表示出来,那将是方便而有用的。例如,已学习过的氧化还原电势图,就是用线段连接组成半电池的两种物质,并在线段上标出测得的标准电极电势,从而归纳了同一元素的各氧化态之间电势的数量关系。
此外,也有人提出了一种表示元素的不同氧化态之间关系的图解方法。它不用标准电极电势而用各种“半反应”的自由能对氧化态作图,清楚地表明了同一元素不同氧化态之间的氧化还原性质。下面以锰为例,绘制自由能-氧化态图。
已知锰在酸性介质中有六种氧化态,即MnO4-、MnO42-、MnO2、Mn3+、Mn2+、Mn。
先求算锰在酸性介质中各氧化态的自由能。
例如,Mn2+的自由能,可根据半反应:
Mn2+ + 2e- ⇋ Mn E°=-1.029V
(初态) (终态)
已知 △G°=-nE°(eV)
G°终-G°初=-nE°
G°初=nE°+G°终
G°Mn2+=2(-1.029)+G°Mn
已知单质的自由能为零。
∴ G°Mn2+=2(-1.029)+0=-2.058eV
即锰的氧化态为+2时,它的标准自由能为-2.058eV。
又如,Mn3+的自由能,可根据半反应
Mn3+ + e- ⇋ Mn2+ E°=1.51V
(初态) (终态)
G°M3+=nE°+G°Mn2+
=1(1.51)+(-2.06)
=-0.55eV
也就是锰的氧化态为+3时,它的标准自由能为-0.55eV。
同理可以求算MnO2,MnO42-、MnO4-的标准自由能,它们分别为0.10、4.62、5.18eV。
再以锰的各种氧化态的自由能为纵坐标,氧化态为横坐标作图,就可得图21-8。
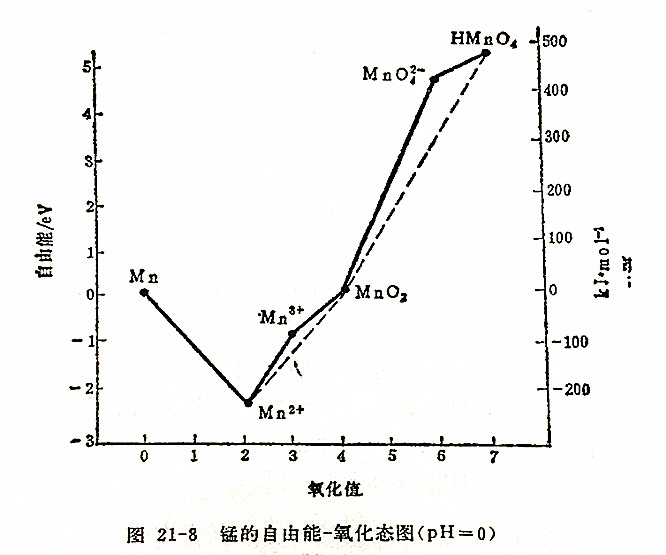
这种图解对于一种元素不同氧化态在溶中的氧化还原性相对强弱的了解提供了很清晰的概念。例如,图中最低点为Mn2+,它表示了Mn2+相对于锰的其它氧化态而言,是此条件下最稳定的。
还应指出的是,上述图形是指pH=0时锰的各氧化态的标准自由能组成的曲线。如果是碱性介质(pH=14)中,锰的各氧化态的标准自由能会有不同数值,上述图中的曲线也就不同。
