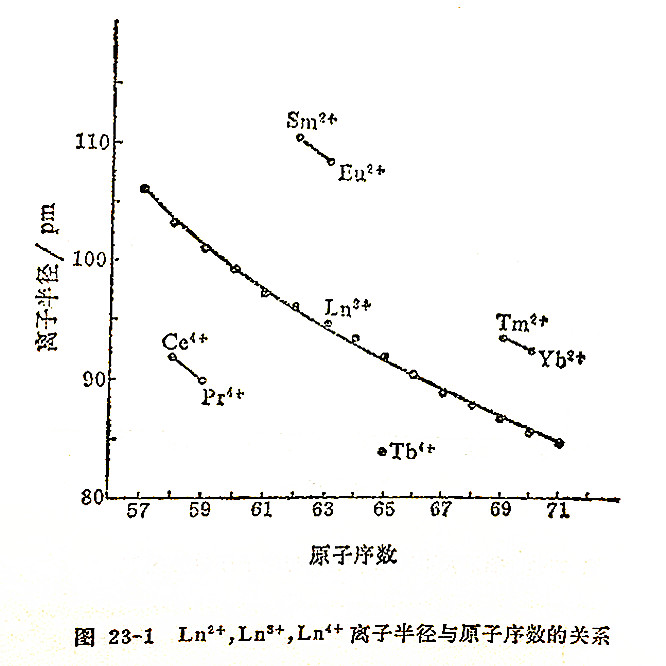
镧系元素的原子半径和离子半径见表23-3,从表中的数据可以看出从Sc经Y到La,原子半径和三价离子半径逐渐增大,但从La到Lu则逐浙减小。这种镧系元素的原子半径和离子半径随着原子序数的增加而逐新减小的现象称为镧系收缩。
表23-3 镧系元素的原子半径和离子半径
|
原子序数 |
符号 | 原子半径(金属半径)/pm | 离子半径/pm | ||
| 2+ | 3+ | 4+ | |||
| 21 |
Sc |
160.8 | 73.2 | ||
| 39 | Y | 181 | 89.3 | ||
| 57 | La | 187.9 | 101.6 | ||
| 58 | Ce | 182.5 | 103.4 | 92.0 | |
| 59 | Pr | 182.8 | 101.3 | 90.0 | |
| 60 | Nd | 182.1 | 99.5 | ||
| 61 | Pm | (181.0) | (97.9) | ||
| 62 | Sm | 180.4 | 111.0 | 96.4 | |
| 63 | Eu | 198.4 | 109.0 | 95.0 | |
| 64 | Gd | 180.1 | 93.8 | 84.0 | |
| 65 | Tb | 178.3 | 92.3 | 84.0 | |
| 66 | Dy | 177.4 | 90.8 | ||
| 67 | Ho | 176.6 | 89.4 | ||
| 68 | Er | 175.7 | 88.1 | ||
| 69 | Tm | 174.6 | 94.0 | 87.0 | |
| 70 | Yb | 193.9 | 93.0 | 85.8 | |
| 71 | Lu | 173.5 | 85.0 | ||
镧系元素中,原子核每增加一个质子,相应的有一个电子进入4f层,而4f电子对核的屏蔽不如内层电子,因而随着原子序数增加,有效核电荷增加,核对最外层电子的吸引增强,使原子半径、离子半径逐渐减少。
镧系元素的离子半径与原子序数的关系见图23-1。
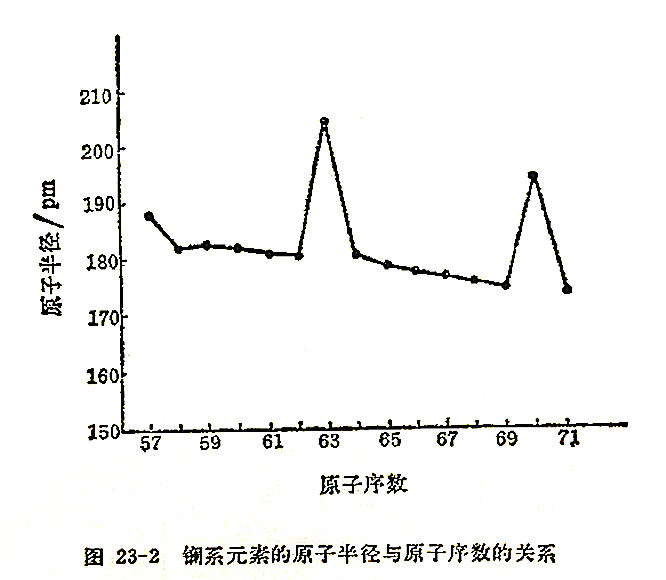
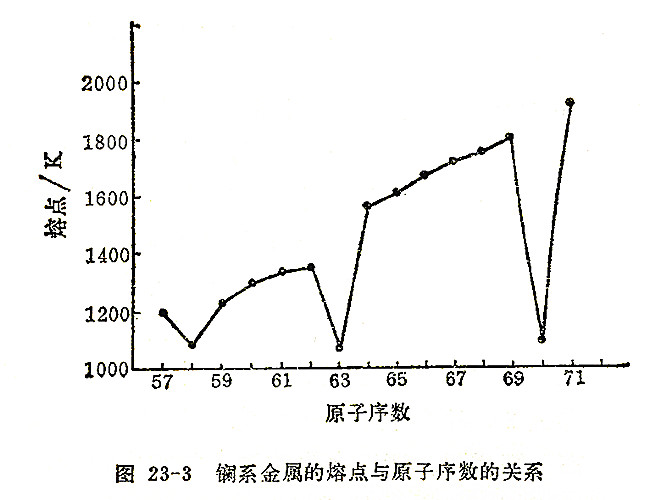
镧系元素的原子半径由图23-2可见,除Eu和Yb反常外,从La(187.9pm)到Lu(173.5pm)略有缩小的趋势,但不如离子半径缩小得多。镧系金属的原子半径都比离子半径大,这是因为镧系元素金属原子的电子层比离子多一层,它的最外层是6s2,4f就居于第二内层,它对原子核的屏蔽就不是85%而是接近100%,因而镧系收缩的效果就不明显了。至于Eu和Yb的原子半径出现反常现象,由于它形成二价离子的倾向很大(Eu2+ 4f7、Yb2+ 4f14),这种具备半充满和全充满的4f层是比较稳定的。在它们的固体中可能仅仅给出2个电子形成金属键;那么2+离子将会大一些,它们之间的结合力也不像其他镧系元素3+离子那样强。所以金属铕和镱的密度较低,熔点也较低,升华能也比相邻的元素低(熔点见图23-3)。
镧系收缩在无机化学中是一个重要现象。前面已提到,由于镧系收缩,使钇成为希土元素的成员,Y常与重希土元素共生于矿物中。而钪的离子半径相差较远(Sc3+ 73.2pm),故一般不与希土矿共生。由于镧系收缩的存在,使ⅣB族中的Zr和Hf,在ⅤB族中的Nb和Ta,ⅥB族中的Mo和W,在原子半径和离子半径上较接近,化学性质也相似,造成这三对元素在分离上的困难。
