电导分析法分为直接电导法和电导滴定法两类。
1.直接电导法的应用
直接电导法是通过测量溶液电导的大小直接求出组分含量的方法。一般先绘制一系列标准溶液浓度与其对应的电导的标准曲线,再测定试液的电导,即可从标准曲线上查出其浓度。不过所测电导是溶液中所有电解质电导之总和,除非是在溶液中只有一种电解质的情况下,测得的电导才能代表所指定电解质的浓度。例如工业用水和工厂废水中溶解电解质成分的测定就是用直接电导法,作为控制指标。纯水制备中也常用测电导连续监测水的质量,它反映水中存在电解质的总量。但应注意,非导电物质的污染是测不出来的。绝对纯水的理论电导率为5.5×10(-8次方)西/厘米(25℃),这是因为纯水中有水分子电离成H+和OH-离子。纯水与大气中CO2平衡时其电导率可达10(-6次方)西/厘米,当然CO2可以通过加热除去。一般蒸馏水电导率为10(-6次方)西/厘米(即电阻率为10(6次方)欧姆·厘米)以上。用电导仪测量水的电导或用兆欧表测量水的电阻都可以检验高纯水的质量。
2.电导滴定法的应用
利用滴定分析中被测溶液电导的変化指示终点的方法叫电导滴定法。例如,用NaOH溶液滴定HCl,H+和OH-离子结合生成难电离的水,溶液电导逐渐减小,到达等当点时溶液电导最小。在加入过量NaOH后电导又重新增加,将电导与所用NaOH溶液体积作图,得到斜率不同的两根直线,如图12-16所示,两根直线的交点即为滴定终点。
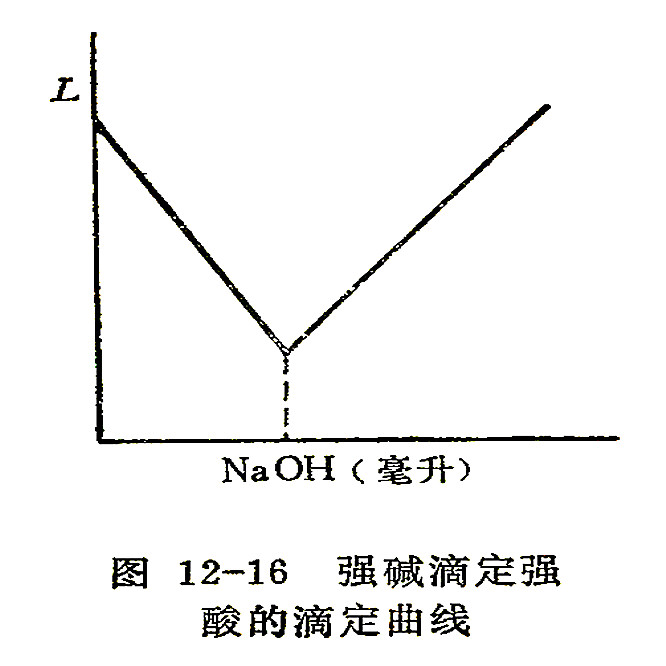
从曲线可以看出,终点附近的读数是没有多大用处的,特别是在终点附近发生沉淀溶解、盐类水解等情况下,终点附近的读数不可靠,常用远离终点的数据来作曲线,这与电位滴定法恰好相反。
电导滴定法在某些场合,例如对于混合酸或混合碱溶液的分析是合适的,用NaOH溶液滴定HCl和HAc的混合液,其滴定曲线可获得二个明显的终点,如图12-17所示。
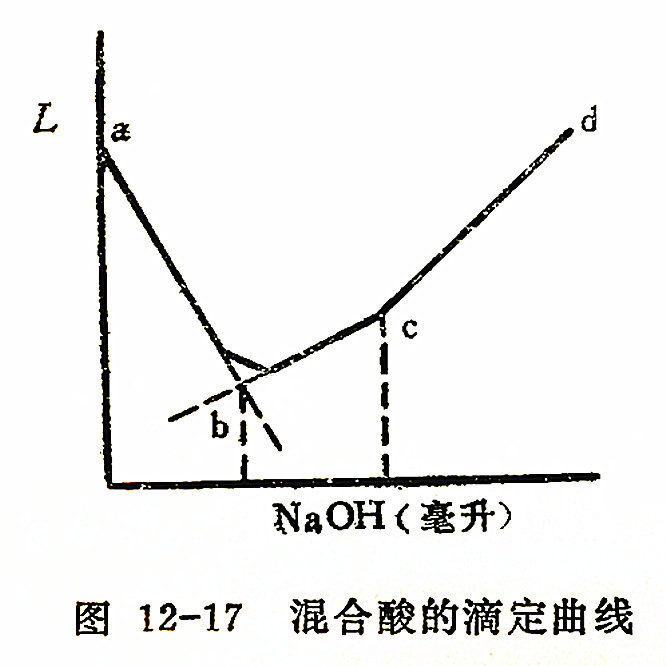
在电导滴定中,由于滴定剂的加入,使溶液稀释,从而电导与滴定剂的体积不呈线性关系,称为稀释效应。通常可用所测电导乘上校正因子(V+V')/V(V-原始溶液的体积,V'-加入滴定剂的体积)予以校正。
电导滴定适用于稀溶液,除了可用于酸碱反应外,也可用于氧化还原反应,沉淀反应和络合反应。
温度对电导有影响,电导分析都应在一定温度下进行,否则应该用温度补偿法进行校正。