在上节中我们看到液体蒸气压的不同与液体分子间引力的不同有关。所有分子彼此之间都有引力。这些引力的本性是什么呢?为什么不同物质分子间的引力大小不同呢?

曾已指出,正电荷中心和负电荷中心不相重合的分子是极性分子。它们具有偶极矩。在HC1分子中,由于氯和氢相比有较大的电负性,在氯原子上有部分负电荷和在氢原子上有部分正电荷;所以HC1分子有永久偶极矩。一个HCl分子的正电端对另一个H且C1分子的负电端的静电引力所构成的吸引力使HC1和同分子量的非极性分子相比有较高的沸点。
非极性分子和极性分子一样都有的一种额外的分子间引力是范德华引カ,它来源于一个分子的核(正电性)对一个相邻
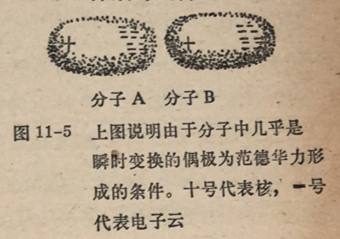 分子的电子云(负电性)的静电引力(图11-5)。因为这种力,图中A分子图11-5上图说明由于分子中几乎是的电子分布可以在瞬时内变成为不对称的并集中在分子的一侧。在这个瞬时内分子中产生了临时偶极。同样,在这同一瞬间B分子的核吸向A分子的负电端和它的负电端远离A分子的负电端,使B分子发生了变形,在一个分子的核和另一个分子的电子云之间产生了相互吸引。同时也发生了两个核之间以及电子云中两个负电中心之间的互相排斥作用。由于电子不断的运动造成位移以至在下一瞬间分子中负电荷的集中又偏移到另一边。这对另一个分子中的电荷分布产生相应的影响导致在两个分子内产生两个新的方向相反的偶极。这些几乎是瞬时变换的偶极导致了分子之间
分子的电子云(负电性)的静电引力(图11-5)。因为这种力,图中A分子图11-5上图说明由于分子中几乎是的电子分布可以在瞬时内变成为不对称的并集中在分子的一侧。在这个瞬时内分子中产生了临时偶极。同样,在这同一瞬间B分子的核吸向A分子的负电端和它的负电端远离A分子的负电端,使B分子发生了变形,在一个分子的核和另一个分子的电子云之间产生了相互吸引。同时也发生了两个核之间以及电子云中两个负电中心之间的互相排斥作用。由于电子不断的运动造成位移以至在下一瞬间分子中负电荷的集中又偏移到另一边。这对另一个分子中的电荷分布产生相应的影响导致在两个分子内产生两个新的方向相反的偶极。这些几乎是瞬时变换的偶极导致了分子之间
的吸引。
范德华引力是很弱的,只有在分子彼此靠近时,即几乎彼此相接触时才能起作用。范德华引力同下面的因素是相对抗的:(1)相邻分子电子云的排斥力和(2)相邻原子的核之间的互相排斥。不过吸引力要比排斥力强些。
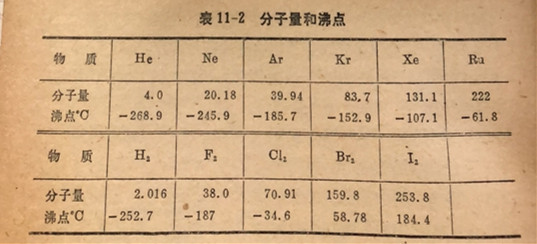
范德华引カ的大小随着每个分子中电子数的增加而变大,因此也随着分子量的増加而变大。分子间引力随分子量而增加的事实反映在有关物质系列如He、Ne、Ar、Kr、Xe、Ru以及F2、Cy、Br2,I2(看表11-2)的沸点依次升高。
作用于分子间的范德华引力的有效性随温度的升高而降低,因为外加的热能增强了分子的运动,因而克服了范徳华引力。换句话说,在较高温度下的动能大于范德华力的吸引能。
在温度足够低时,由于范德华力的作用使物质如惰性气体和单质卤素能够凝聚成液体和冻结成固体。
一般而言,由没有永久偶极矩的独立分子所组成的液体,相应于其分子量来说它的沸点是比较低的,因为在蒸发过程中只要克服很微弱的范徳华引力。在这类分子中,正电荷中心和负电荷中心是重合的。实例有如惰性气体和卤素分子以及其它对称性分子如CH4、SiH4、CF4、SiF4SFs和UF6等。具有永久偶极矩的分子型物质H2O、HF和C2H5OH(乙醇)等相对于它们的分子量来说则有颇高的沸点。
编辑网站:https://www.999gou.cn 999化工商城
