催化剂活性的测定方法
三水锰矿 / 2021-07-28
第二节催化剂活性的测定方法
催化剂活性是催化剂最重要的性质。根据化剂的研制、现有催化剂的改进、催化剂的生产控制和动力学数据的测定以及催化基础研究的不同,可以采用不同的测定方法。也可因反应及其所要求的条件不同,采用不同的测定方法。例如强烈的放热和吸热反应、高温、低温、高压和低压等反应条件。
测定催化剂活性的方法,大致可分为两大类,即流动法和静态法。流动法的反应系统是开放的,供料连续。静态法的反应系统是封闭的,供料不连续。流动法中包括一般流动法、流动循环法(无梯度法)、催化色谱法,以及沸腾床和移动床催化剂活性的测定。静态法中包括一般静态法及其改良的静态循环法。由于工业生产多为连续流动系统,所以一般流动法应用最广。流动循环法和催化色谱法主要用于研究反应动力学和机理。静态法适用于高压或原料要求消耗少的过程,以及催化基础研究。
一、催化剂活性的表示方法
对于催化剂的活性,在第一章第二节里已作了定性介绍,本节将给以定量的叙述。
在催化剂存在下,反应速度可以作为衡量催化剂活性大小的尺度。若在时间内,反应物减少了m克分子,生成了m,克分子的反应产物,则其反应速度有三种表示方法:
以催化剂的容积为基础时
ω=-1/V・dnA/dt=1/V・dnp/dt(克分子/立方厘米・时)
以催化剂的重量为基础时
ω=-1/W・dnA/dt=1/W・dnp/dt(克分子/立方厘米・时)
以催化剂的表面积为基础时
ω=-1/S・dnA/dt=1/S・dnp/dt(克分子/立方厘米·时)
上式中V一一催化剂的表观容积;
W一一催化剂的重量;
S一一催化剂的表面积。
在工业生产中,催化剂的生产能力大多数是以化剂单位体积为标准,并且催化剂的用量通常都比较大。所以这时反应速度应当以单位容积表示。
在某些情况下用催化剂单位重量作为标准表示催化剂的活性比较方便。例如在实验室里当样品只有数毫升时,测量体积就会带来大的误差,又如工业生产中某些特殊情况下,用催化剂重量:作为标准更便于实际应用,低压聚乙烯化剂就是其中的一个例子。
当比较固体物质的固有化性质时,用上述两种表示方法,就不够严格。这时应当以化剂单位表面积上的反应速度作为标准。因为催化反应仅在固体的表面上(当然包括内表面)发生,与体相物质的含量无关。
根据催化剂的视比重和比表面数值,上述三种活性表示方法,可以相互换算。
当采用封闭系统反应器时,测定某一反应时间下的转化率.当采用流通系统反应器时,则测定不同空速下的转化率。若每小时供料速度为F(厘米^3/时),催化剂的表观体积为V(厘米^3),则空速为F/V(时^-1)。当原料为气体或蒸汽时,通常将其体积换算为0℃和1大气压的体积,这时的反应速度称气体时空速度(GHSV)。当原料为液体时,则换算到20℃时的体积,这时的反应速度称为液体时空速度(LHSV)。
为了实际工作的方便,在催化剂的研制阶段,通常在相同的试验条件下,以各种样品提供的转化率,作为衡量催化剂活化的标准。应当注意,这里所说的活性是相对的和有条件的。
若一反应为
aA+bB->cC+dD
最初A的克分子数为NA0,反应后A和C的克分子数分别为NA和Nc,则
A的转化率 XA=(NA0-NA)/NN0
C的收率 Yc=aNc/cNA0
C的选择性 S=aNc/c(NA0-NA)
该反应的物料平衡为
MB=(未转化的A和B所占分数)+(主要产物的收率)+(分析出的副产物的收率)由于测量和分析都有误差,所以物料平衡MB常不等于1。主要原因为:副产物没有完全捕集,反应器出口分析有误差;原料送入速度不准确反应产物捕集不完全。
由此产生下列误差:
转化率的误差 εx=(1-MB)[(1/XA)^-1]
收率的误差 εy=MB-1
选择性的误差 εs=MB・XA[1-MB(1-XA)]
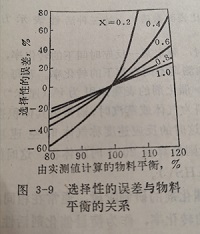
收率的误差决定于物料平衡。转化率和选择性的误差,随转化率发生变化,在相同的物料平衡下,当转化率小时误差大,转化率大时误差小。
在不同转化率下,选择性的误差与物料平衡的关系绘于图3-9。
二、流动法
流动法现在仍然是广泛采用的测定方法。由于该法与工业生产的实际流程接近,测定装置比较简单,所以在石油炼制、肥工业、基本有机合成和合成材料的单体合成中,几乎都是采用这种方法测定催化剂活性的。在测定活性时,将反应混合物以一定空速通入充填催化剂的反应器。然后分析反应后的混合气体的组成,或者在某些情况下,分析一种反应物或反应产物。
1.影响化剂活性测定的因素
用流动法测定化剂的活性时,要考虑气体在反应器中的流动状况和扩散现象,才能得到关于催化剂活性的正确数值,这在本章第一节中已作了比较详细的叙述。
现在已经拟出了应用流动法测定催化剂活性的原则和方法。利用这些原则和方法,可将宏观因素对测定活性和对研究动力学的影,减小到最低限度。其中为了消除气流的管壁效应和床层的过热,反应管直径(dr)和催化剂颗粒直径(dg)之比应为:
6<dr/dg<12
当dr/dg>12时,可以消除管壁效应。但也有人指出,甚至当dr/dg>30时,流体靠近管壁的流速已经超过床层轴心方向流速的10~20%。
另一方面,对热效应不很小的反应,当dr/dg>12时,对床层的散热带来困难。因为催化剂床层横截面中心与其径向之间的温度差由下式决定:
△to=ωQdT^2/16λ*
式中
ω一一单位催化剂体积的反应速度,克分子/厘米^3时;
Q一一反应的热效应,千卡/克分子;
dT一一反应管的直径,厘米;
λ*一一催化剂床层的有效传热系数,千卡/厘米·时·度。
由上式可见,温度差与反应速度、热效应和反应器直径的平方成正比,与有效导热系数成反比。由于有效扩散系数λ*随催化剂颗粒减小而下降,所以温度降随粒径减小而增加。当为了消除内护散对反应的影响而降低粒径时,则增强温度降升高的因素另一方面,温度降随反应器直径的增加而迅速升高。因此,要权衡这儿方面的因素,以确定最适的催化剂粒径和反应管的直径。
用流动法测定催化剂的活性时,要考虑外扩散的阻得作用为了避免外扩散的影响,应当使气流处于流的条件。因为层容易产生外扩散对过程速度的阻得,这在第一节里已进行了分析,这里不再重复。
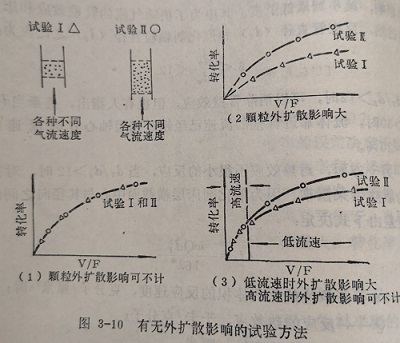
反应是否存在外扩散的影响,可由下述简单试验查明。安排两个试验,在两个反应器中催化剂的装量不等,在其他相同的条件下,用不同的气流速度进行反应,测定随气流速度变化的转化率。
若以V表示催化剂的装量,F表示气流速度,试验Ⅱ中催化剂的装量是试验Ⅰ的两倍,则可能出现三种情况,如图3-10所示。只有出现(1)的情况时,才说明实验中不存在外扩散影响。
2.测定活性的实验方法
在实验室里使用的管式反应器,通常随温度和压力条件的不同,可采用硬质玻璃、石英或金属材料。将催化剂样品放进反应管里。催化剂层中的温度,用安装的热电偶测量。为了保持反应所需的温度,反应管装在各式各样的恒温装置中,例如水浴、油浴、熔盐浴或电炉等。
原料加入的方式,根据原料性状和实验目的也各有不同。当原料为常用的气体时,可直接用钢瓶,通过减压阀送入反应系统。例如氢气、氧气、氮气等。当然对于某些不常用的气体,需要增加发生装置。在氧化反应中常用空气。这时可用压缩机将空气压入系统。若反应组份中有在常温下为液体时,可用鼓泡法、蒸发法或微型加料装置,将液体反应组份加入反应系统。
根据分析反应产物的组成,可算出表征催化剂活性的转化率。在许多情况下,只需要分析反应后的混合物中一种未反应组份或一种产物的浓度。混合物的分析可采用各种化学或物理化学方法。为了使测定的数据准确可靠,测量工具和仪器,如流量计、热电偶和加料装置等,都要严格校正。
3.流动法测定催化剂活性的装置
流动法测定活性,因反应性质和条件的不同,有各种各样的装置。作为例子,以下叙述接触硫酸催化剂和氧化制苯酐催化剂的活性测定。
(1)钒催化剂的活性测定
二氧化硫氧化生成三氧化硫为一强放热可逆反应:
SO2+1/202≒23千卡(25℃)
工业上一般采用以五氧化二钒为主要活性组份,制成圆柱状或环状催化剂。其活性测定装置如图3-11所示。试验在常压下进行。原料气为空气、氧气和二氧化硫,分三路送入系统。氧气是为了进行高氧浓度气体实验之用。压缩空气经活性炭过滤器1除油后,经浓硫酸洗涤瓶2和流量计3进入混合器4。氧和二氧化硫由钢瓶进入混合器与空气混合。混合后的原料气送入反应器5。反应温度用热电偶6测量反应前后的气体由碘量法用分析瓶和吸气瓶分析SO2。即可算出二氧化硫的转化率。
由于该反应为强放热反应,所以控制催化剂层的温度均匀一致,对测定可靠的活性数据是非常重要的。为此可采用如图3-12结构的电热炉。镍铬电热丝分三组供热,以便调节催化剂层的温度。颗粒钒化剂充填在反应管和热电偶套管的环形空间里。镍格或铂一佬丝热电偶的接点可在催化剂层中的套管里上下移动,以便测量各点温度。
如前所述,反应管的直径要适中,以避免气流和温度分布的不均一。同时可将大颗粒催化剂破碎和用惰性固体颗粒如瓷球稀释。
催化剂的活性可用在一定条件下的转化率x表示。也可以用SO2在钒催化剂上氧化为SO的反应速度表示,例如:
dx/dt=k/a((xeq-x)/x)^0.8(b-ax/2)273/T
式中
x一SO2的转化率;
t一接触时间,秒;
k一一反应速度常数,秒^-1;
a一SO2的起始浓度,%体积;
b一氧的起始浓度,%体积;
xeq一SO2的平衡转化率;
T一绝对温度。
(2)萘氧化生产苯酐固定床催化剂的活性测定
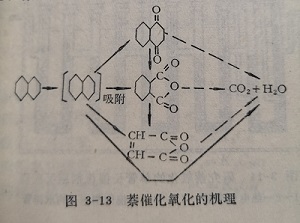
120氧化为放热不可逆反应。在催化剂上除生成苯、CO2和HO的主反应外,通常还伴随着少量副反应,反应的最终产物是二氧化碳和水(见图3-13)。
萘的催化氧化和二氧化硫的催化氧化完全不同,它不仅要求催化剂有高的活性,而且还要求具有良好的选择性。选择催化剂的适宜组成和制备方法,以及合理的反应条件,可使的氧化反应基本上沿着生成苯酐的方向进行,并停留在生成苯酐的阶段。这是一切烃类制取相应的含氧化合物的共同要求。工业上普遍采用V2O-K2SO-SiO2系催化剂,用列管式反应器或沸腾床反应器。
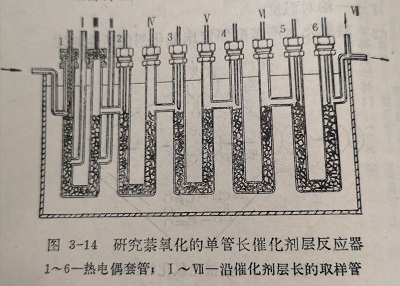
采用单管长催化剂层的测定方法,可使测定活性的条件接近于工业生产的条件,因此所测得的活性和动力学数据可直接用于工业生产。
反应器的结构形式之一绘于图3-14。反应管长2.5米,直径1.9厘米,安放在熔盐恒温槽中。为了便于控制和测量床层的温度,以及分析沿催化剂层的混合气体的组成,将反应管等分为五个串连的U形反应段。每段催化剂层高45厘米,并各有测温和取样支管。第一段的两个取样支管分别位于催化剂层入口的15厘米和30厘米处。全部床层有六个测温点,采用铁一康铜热电偶。
图3-15为。空气由空压机经门2,流量计3和安放在预热炉6中的蛇形管,进入蒸发器12,在电炉9中将反应混合气体预热到280℃,然后进入反应器7。反应后的混合物在玻璃冷凝器6中冷凝,未冷凝的氧化产物进入装有瓷环的洗涤器5中用水洗涤。水银压力计用于控制和调节空气流量的压力。
反应产物苯酐和顺丁烯二酸酐用碱确定,1,4-萘醌用光电比色法分析,CO2和CO则用气体分析器分析。
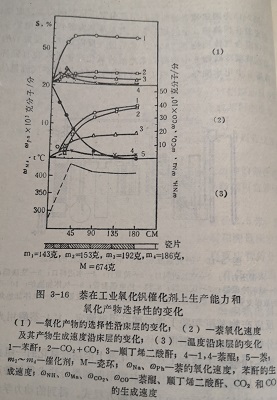
图3-16绘出了在工业钒催化剂上沿层长氧化的一组典型实验结果。从第三反应段到床层末端用图解分法求得每种产物生成速度与浓度关系的动力学经验方程式。得到的动力学规律如下:
苯酐的生成速度 ω1=K1CN
萘醌的生成速度 ω3=K3CN^2
萘醌的氧化速度 ω4=K4CNH
萘的深度氧化速度 ω5=K5CN
这里K1~K5为相应反应的速度常数,CN和CNH分别为萘和萘醌的浓度。
由于列管式反应器在化学工业中的广泛应用,单管长层的测定方法对研究工业催化剂具有重要的意义。因为这种方法不仅能测得催化剂性能沿床层的变化,而且还可以通过试验来选择温度、浓度、气体流速的最适条件,以及求得动力学经验方程式。所有这些结果可以直接用于工业反应器的设计和确定最适操作条件。
4.流动法研究催化反应的动力学
如前所述,用流动法研究反应动力学时,反应管直径、催化剂颗粒大小和层高应有适宜的比例。一般要求沿反应管横截面能排6~12粒化剂,催化剂层高应超过直径2.5~3倍。例如,若反应管直径为8毫米时,化剂颗粒直径为1毫米,层高为30毫米。
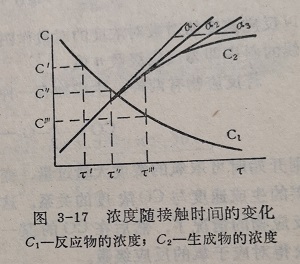
为了测量催化剂层的温度,还在反应管中安装热电偶套管。在反管与管之间要求能排放6~12粒催化剂。当气流速度、温度和反应物浓度稳定时,对应于某一气流速度(即相应的接触时间)分析反应后的气体组C成,即得一组反应物和反应产物的浓度与接触时间的数据。然后在其他条件不变仅变更气流速度的情况下,得列另一组浓度与接触时间的数据。以浓度对接触时间作图即可得到图3-17所示的曲线。图中C1和C2分别表示反应物和反应产物的浓度。曲线C1的斜率为反应物的消失速度,曲线C的第率则表示反应产物的生成速度。以反应产物的生成速度对反应物浓度作图,可以得到由反应级数决定的不同形式的曲线(图3-18)。这是因为对于反应
A→B
dc/dτ=KC^n
取对数
㏒dc/dτ=㏒K+n㏒C
以反应速度的对数对浓度的对数作图,则得一直线(图3-19)。直线的斜率即为反应级数n值。
若反应物有两种,生成物有一种,例如:
CO+1/2O2→CO2
则开始时可取氧的浓度大量过量,变更CO的浓度,测定二氧化碳的生成速度与CO浓度的关系。这样就把问题简化为只有一种反应物的情况了,然后在CO的某一浓度下变更氧的浓度,即可求得对应于氧的反应级数。
这时动力学方程式可以写成如下形式:
-dc/dc= KCco^nCo2^m
式中
n一一为CO的反应级数;
m一一为O2的反应级数。
用这种方法求得CO在氧化铜上氧化反应的级数,n=1;m=0。这时动力学方程式为
-dc/dτ=KCco^n
若已知在一定温度下的反应速度和动力学方程式的形式,
可求得反应速度常数。
K=ω/C^n
由上式可见,当反应为零级时,则
K=ω即速度常数等于反应速度。
速度常数与温度的关系,由阿累尼乌斯指数定律决定:
K=Koe^-E/RT
取对数
㏒K=㏒Ko-E/RT㏒ε
式中 R=1.9872卡/度・克分子。
由上式可知,在两个温度下测得对应的两个速度常数值后,即可由下式算出反应的活化能:
E=(㏒K2-㏒K1)×1,9872×2.303/T1^-1- T2^-1=4,576㏒(K2/K1)/ (T2-T1)/ T1T2
知道了反应的视活化能和在某一温度下的速度常数,即可算出在其他温度下的速度常数。这就可以对设计反应器和解决生产条件最佳化有关问题进行必要的工程计算。流动法的优点是装置比较简单,连续操作,可以得到较多的反应产物,便于分析,并可直接对比催化剂的活性。适用于测定大批工业催化剂试样的活性。
由于流动法是采用的微分反应器,不能直接测量反应速度。不能完全避免在床层中存在气流速度、温度和浓度梯度,使测定的数据可靠性下降。因此在研究动力学时,采用下述较为先进的流动循环法为宜。用这种方法可以获得有关催化剂的生产能力和选择性的更为可靠的数据,并且催化剂的用量少,甚至用一化剂也可进行测定。
三、流动循环法
流动循环法是1950年提出的,也叫做无梯度法。
1.流动循环法的基本原理
流动循环法的基本原理是将反应后的物料大部分循环,小部分导出系统。循环的物料与补充的新鲜反应物混合,然后再进入催化剂层反应。补充的新原料与导出的反应后物料之间,要相通应,以便达到循环系统的稳定。当循环物料量与新补充物料量之比足够大时,则混合气体在催化剂进出口的浓度变化很小。以致实际上可以认为在催化剂层中不存在浓度和温度梯度的影响。所以也有人称之为流动循环无梯度法。
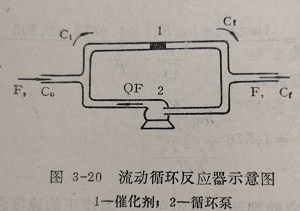
图3-20为流动循环反应器的示意图。若反应混合物进入循环系统的速度为F,反应物的浓度为C0;从循环系统流出的反应后的混合物的流速也为F,浓度为Cf:循环量是进料量的倍反应物在催化剂层入口处的浓度为C,则反应物进入催化剂层的物料平衡为
Ci(Q+1)F=CiQF+C0F
由此得
Ci=(C0+CiQ)/(Q+1)
若催化剂的表观体积为V,则反应速度ωv可由下式计算:
ωv=F/V (Q+1)(Cf-Ci)=F/V(C0-Cf)=F/VC0X
式中X为反应物A的转化率。
若以催化剂的重量P(或表面积S)代V,则单位催化剂重量(或表面积)表示的反应速度为:
ωw=F/WC0XA,和ωs=F/SC0XA
由此可见,只要求得反应物的转化率,就可以直接而简便地算出反应速度。
反应物在进出循环系统的混合物中的浓度差(Co-Cf),是在催化剂层进出口浓度差(Cf-Ci)的(Q+1)倍,这就便于对反应组份的分析。
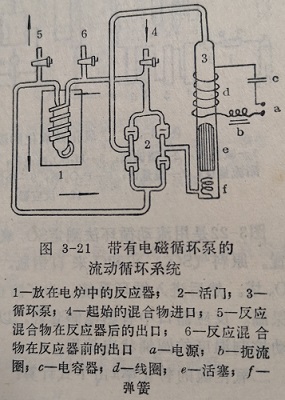
应用流动循环法的重要条件是Q>>F,方能得到正确的结果。在循环系统中用循环泵使反应混合物高速循环。循环泵可以是机械的、活塞的或电磁的,以及其他类型。图3-21为带有玻璃电磁循环泵的一种类型。其作用原理如下:由周期的切断线路置或时间继电器向线圈d中提供周期的电流,从而在线圈d中周期的产生磁场。在磁场的作用下内部装有铁磁物质的玻璃活塞e吸向上方,推动着管中的气体向上运动,同时在活塞下部吸入气体。当电路被切断时,线圈d的磁场消失,由于重力的作用,活塞落在弹簧f上。在活塞上下周期运动的同时活门2的四个玻璃片中斜对角的两个打开,另两个关闭。活门的这种动作,使气体进出始终沿着头的方向运动,从而达到了气体循环的目的。
2.流动循环法的测定方法
用流动循环法测定催化剂的活性与流动法没有原则的区别主要的不同点在于,为了消除浓度和温度梯度而使大部分反应合物循环。
图3-22是用流动循环法测定SO2氧化为SO的催化剂活性的装置。原料气SO2、N2和O2来自钢瓶,分别经精制和计量后进入P2O塔。然后进入循环系统。为了防止冷凝,活门10要用电加热保温。反应器口中有热电偶套管,以便测量温度。反应器放在自动控制温度的圆桶状电炉里。
二氧化硫的转化率x由下式计算:
x=(Co-Cf)·1000C/C0(100-1,5Cf)
式中C0和Cf,分别为SO2的起始浓度和最终的浓度,以体积%表示。
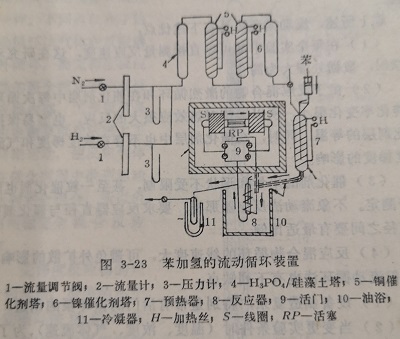
图3-23为研究苯加氢生成环烷的流动循环装置。循环泵为另一种形式,两个线圈S交替的产生磁场,推动循环活塞RP。H2和稀释剂N2经过计量、精制和干燥后,在预热器8与苯混合,所需要温度后,进入反应器9。反应后的混合气体在冷凝器里将苯和反应产物冷凝。分析后即可算出转化率。
3.流动循环法研究反应的动力学
用流动循环法研究反应动力学,最大的优点是可以直接测定以微分形式表示的反应速度:
ω=F/V-4(Co-Cf)
若以反应产物在单位时间内的生成速度表示则得:
ω=F/V C
式中C为反应产物的浓度。
测定时,只需在一定温度下变更通过循环系统的气体供料速度,即可简便而迅速的算出相应的确度很高的反应速度。不集流动法那样,求反速度需要用图解微分法用图解做分法求应速度时,确度要差的多。
有了在不同接触时间下的反应速度和度值,以下的运算和流动法一样,用图解法求出反应级数,以及田速度常数求得视化能。
综上所述,流动循环法具有下述优点:
(1)在每个实验中都可以直接测量反应速度,这在研究动力学时,数据处理大为简化。
(2)由于反应混合物的激烈循环和在催化剂层中每次循环的转化率变化很小,所以即使对热效应很大的反应,也容易保持催化剂层的等温,同时,在催化剂层中也不存在浓度梯度和气速度梯度的影响。
(3)化剂的用量和形状不受限制,甚至一粒催化剂也能进行测定。不象流动法反应器那样,要求反应器直径与催化剂粒直径之间要有最适比例。
(4)反应混合物循环的线速度大,可避免外扩散的影响。但流动循环法也有下列缺点:
(1)设备制造复杂,特别是带有活门的循环泵的制造。
(2)当变更实验条件时(温度、浓度、气体流速),为了建立与新的实验条件相对应的稳定浓度,需要较长的时间,因为这时用新的混合物组成取代循环中的气体,必须通入不少于6倍的气体。一般在实验室研究的条件下,气流速度为200~500厘米分,循环的体积约为1升,所以这种操作需要半个多小时的时间。
(3)研究动力学时,在混合物中有水蒸汽或易凝聚的产物时,就使装置复杂化,循环泵和反应器都需保温。同时随着凝聚物在循环系统中的累积,会严重影响试验工作的进行。
(4)在研究产物有聚合作用的反应时,循环泵的活门容易被粘住,需要停工清除。为了克眼以上缺点,采用结构简单的无梯度反应器。这种反应器可以满足对流动循环装置的要求,又没有上述的缺点。
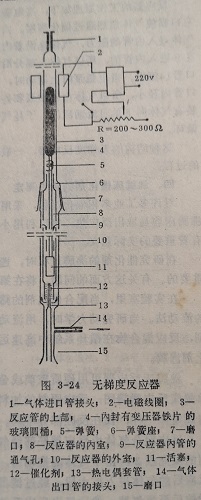
4.无梯度反应器
无梯度反应器的结构原理和流动循环装置样不同点仅在于流动循环法气体在反应器的整个循环安装在反应器内部。工作原理是由电磁泵带动活塞上下周期运动,使反应气体在化剂层中激烈运动达到完全混合,所以也可叫做完全混合反应器。无梯度反应器的尺寸和容积,显著的小于流动循环法的循环系统。它的容积根据需要可缩小到10~20毫升,甚至2毫升。
图3-24为无梯度反应器的一种结构类型。它主要由反应器的外管、内管、电磁泵4带动的活塞11以及热电偶套管13组成。外管中部以口相连,下部的磨口与热电偶套管相接。内管下部有格板,供充填催化剂之用。内管中上部的管壁开有气孔,以便气体循环通过。上端有弹簧6以承接弹簧5。
反应器的工作原理如下:当电磁泵4向下运动时,下端的塞11驱使气体急烈通过催化剂层。由于气体出口管14的阻力大于气体进入内管的阻力,气体是沿着内外管夹层空腔向上经内管气孔9进入内管的,所以气体大部分沿箭头方向运动,小部分由出口管14流出。当电磁泵向上运动时,由于外管上部膨胀和气体入口管内径小,所以气体由电磁泵和外管壁之间向下流动,活塞上装有气体向下单向流动活门。于是气体形成通路,并在反应器内循环。
这种结构的无梯度反应器,一般限于研究有高沸点物质参加的过程。
四、沸腾床催化剂的活性测定
对许多工业多相催化过程,采用沸腾床生产是特别有利的。沸腾床容易取出反应热,可以利用小颗粒催化剂,因此研究它具有着重要的实际意义。
在研究催化剂的沸腾过程时,选择最适的流体力学条件是很重要的。有关这方面的问题,将在第四章中讨论。在实验室里,当配合催化剂的筛选进行测定时,可用较简单的流动法。当研究动力学时,用流动循环法较好。前面已经提到,反应混合物在循环系统中高速运动所产生的推力,足够使催化剂沸腾。
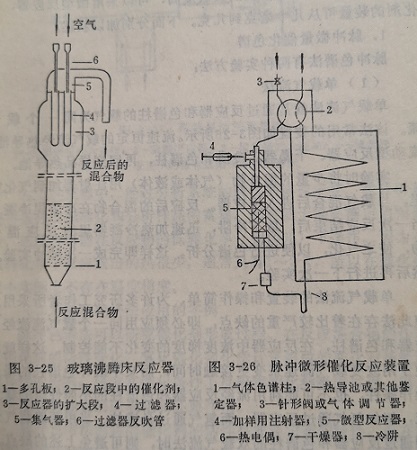
沸腾床反应器可用硬质玻璃或金属材料制造。图3-25是玻璃沸腾床反应器简图,反应原料的加料、精制、计量和产物的分析与固定床一样,仅在反应部分不同。
反应混合气体由反应器底部经气体分布板1,进入装有催化剂的反应段2,由于气体的推动力,催化剂在这里呈沸腾状态。反应后的气体进入扩大段,经过滤器除去气流夹带的某些催化剂微粒后至集气器,然后导出反应系统。过滤器隔一定时间要用空气反吹,以防堵塞。
沸腾床技术已应用于研究许多过程的催化剂和动力学。如丙烯氨氧化为丙烯、乙烯氧化为环氧乙烷、氧化为苯酐、氨的合成,以及二氧化硫的氧化等。
五、微量催化色谱法
色谱分析法具有高效、高灵敏度、快速和易于自动化的优点,现在已成为石油与化工生产和科研工作中最广泛采用的分析方法。色谱分析法的基本原理是根据各种物质的吸附性能不同,进行分离,从而达到分析的目的。利用色谱分析法的原理研究催化剂的活性和催化反应动力学的方法统称为微量催化色谱法。常用的有两种,即脉冲微量化色谱法和稳定流动微量催化色谱法。前者在实验时每隔一定时间向反应器中加入反应物,因而化层中的化学反应是周期性的以脉冲形式进行的,然后,接连色仪进行分析,故称为脉冲色谱法。稳定流动微量催化色谱法,和一般的流动法相似,其差别仅在于实验装置与色谱仪联结,周期的取样分析。由于色谱法的灵敏度高,可以采用微型反应器,化剂的装量可从几十毫克到几克。下面分别加以叙述。
1.脉冲微量催化色谱脉冲色谱法有两种实验方法:
(1)单载气流法
单气流法就是通过反应器和色柱的气为同一个气流。该法常用的装置如图3-26所示。流速恒定的载气流经热导池流动型反应器、干燥器、冷阱和色谱柱,再回到样品热导池。
实验时将少量的混合物(气体或液体)用注射器加到气化室里,与载气混合后进入反应器。反应后的混合物在冷阱里冷凝。当一次反应结后,取下冷阱,迅速加热冷凝器里的反应混合物,使之气化,以便进行色谱分析。这样即完成一次脉冲实验然后再进行下一次实验。
单载气流法的装置和操作简单,为许多研究工作者所采用。但此法存在着比较严重的缺点,即必须应用同一个载气流流经反应器和色谱柱,在反应器中浓度梯度的变化不能控制。这样就不便于用改变载气流速来变更接触时间,而又不破坏色谱柱的最适操作条件,也不可能利用流经反应器和色谱柱的不同性质的载气流,例如氧气通过反应器,而氢气通过色谱柱。当用两路载气分别通过反应器和色谱柱的双载气流法时,则可避免上述的缺点。
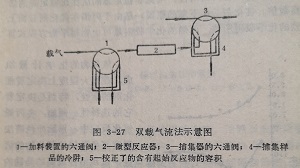
(2)双载气流法
双载气流法的实质是通过反应器和分析系统的载气,互相独立的,互不的。它的基本原理示于图3-27。载气通过六通1、反应器2和阀3。当转动阀1时,反应混合物由校正了体积的5中流入反应器2,进而到充填了惰性物质或吸附剂的冷阱4中。在这里收集和冷凝反应产物及剩余的反应物。当冷阱收集了样品后,转动门,迅速加热被冷凝的试样到需要温度,用载气将混合物送入分析系统。
在上述流程中,经过分析系统的载气的流速不变。在分析系统中条件的标准化和分析样品的富集,都有助于提高测定的精确性。这就有可能在反应物的低转化率(到10%)下操作。因为在低转化率下反应放出的热很少,通常只有1~2卡,所以在催化剂层中实际上不存在温度梯度。
(3)脉冲色谱法应用的实例
脉冲色谱法可以研究催化剂形成过程、在反应混合物的作用下催化剂的活性变化、氧化催化剂化学计量组成的变化对活性和选择性的影响,研究在催化条件下反应物的化学吸收过程,以及研究氧化物催化剂的氧化和还原作用。脉冲色谱法测得的催化剂的活性是非稳定态的活性。而在前面叙述的几种测定方法,都是测定稳定态的活性。这是因为反应物以脉冲式的进入反应器,反应物所接触的是催化剂的“干净”表面,在反应物的作用下,催化剂表面的吸附作用和化学变化都有达到平衡。
图3-28为丙烯在氧化铬催化剂上用氧氧化时,催化剂的活性变化与脉冲序号的关系。由图很明显,随着向氧化铬化剂中加入丙烯和氧次数的增加,化剂的活性迅速下降,当脉冲数增加到一定程度时,催化剂的活性趋于平稳,可以认为,这时的活性接近催化剂稳定态时的活性。可见非稳定态的活性比稳定态的活性高数倍。催化剂活性下降的原因,是由于两烯在催化剂表面上强烈的化学吸附所致。丙烯的化学吸附量可由物料平衡方程式算出。
氧化物的化学计量组成,在很大程度上决定着催化剂的活性,特别是决定着它的选择性。例如:在丙烯氧化反应中,用脉冲色谱法测定了各种锑的氧化物的活性,发现活性最高的是锑的五氧化物。根据这些数据,有时可以判断复杂氧化物催化剂的活性组份。在这个例子中,因为锑的五氧化物是活性最高选择性最好的催化剂,所以这些性质应当出现在含有五价阴离子的NiSb2O6、FeSb2O6、CuSb2O6、FeSbO4等化合物中。
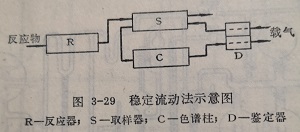
2.稳定流动量催化色谱法
该法的实质是将采用微型反应器的一般流动法的反应系统,中间隔着取样器与色谱分析系统连结(图3-29)。反应混合物以恒定流速进入微型反应器R,反应后的混合物经取样器S流出。气经鉴定器D,在取样器中将一定量的反应后的混合物送至色谱柱C,分离后再经鉴定器D流出。这样即可对稳定的反应进行周期的分析。
这种实验方法对评价催化剂的活性稳定性和寿命有很大的实用意义。如用于动力学数据的测定,也比一般流动法优越。
六、静态法
静态法是最早的也是过去最常用的方法。用静态法测定催化剂的活性时,在封闭的系统内反应,一直进行到热力学平衡或反应物完全转化为止。由于反应物浓度随反应时间逐渐降低,所以反应速度也随时间连续下降。如在研究的容积里,温度保持恒定,又不存在扩散影响,则在反应系统内就不会出现温度梯度和浓度梯度。同时温度也不随时间改变。
对于测定分子数改变的反应,用静态法是方便的。因为这时可以测定随时间而变化的系统压力,算出转化率。当反应分子数不变时,就需要采用复杂的分析方法。
当催化剂的组成及其活性表面随反应混合物的组成变化而改变时,就不能用静态法。
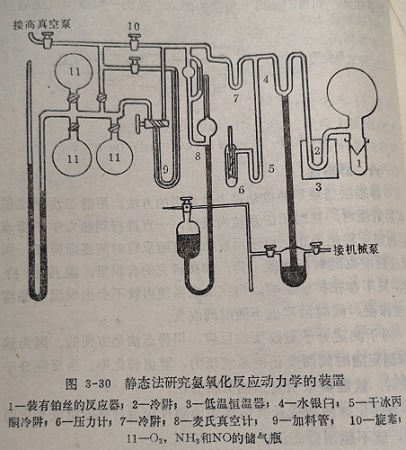
静态法的主要优点是可以利用少量的反应物。例如稳定的和放射性同位素,可以应用任何形状的催化剂,如金属块、薄膜或丝等,而且一个实验即可得到整个动力学曲线。现在静态法主要用于础研究。图3-30是研究氨在铂丝催化剂上氧化的动力学装置。
静态法的主要缺点是在封闭系统内进行反应,得到的数据是积分性质的。
为了求反应速度,需要对实验数据进行图解微分,并且还可能存在温度梯度和浓度梯度。因此在工业催化剂的研究中,很少采用这种方法
当用静态法研究速度比较快的反应,或是在低压下进行的反应,这时反应速度可能受到外扩散的影响。如果在封闭系统内增加拌装置,例如玻璃电磁循环泵或其它仪器,可以避免外扩散的阻碍作用。这种改进的静态法也称为准静态法。
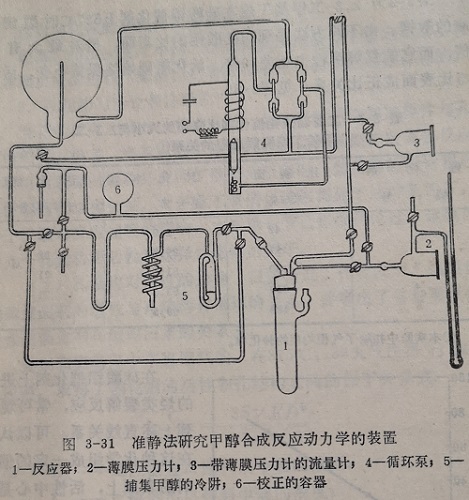
图3-31为研究甲醇合成反应的动力学装置。封闭系统内的气体在玻璃电磁循环泵的作用下通过催化剂层进行激烈的循环,这样既可消除外扩散的影响,也能迅速的将反应热带走,不致引起催化剂层的过热。但准静态法的装置比较复杂。
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)