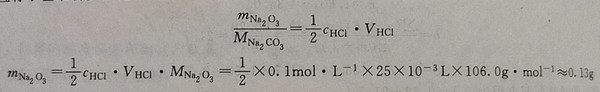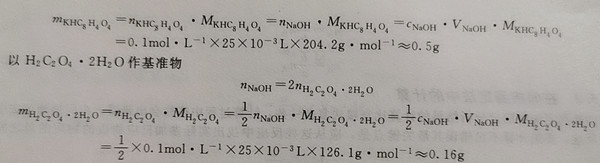滴定分析法是化学与化工类各学科进行分析的既普通又重要,且应用相当广泛的一类分析检测方法。根据化学反应的不同,其分析方法可分为酸碱滴定法,沉淀滴定法,配位滴定法和氧化还原滴定法四种类型。本文重点围绕滴定分析的有关概念和计算进行介绍。
3.1要点与难点
要点
理解相关名词术语:标准溶液、滴定分析法、滴定、基准物、标定、化学计量点。指示剂、终点、终点误差,滴定分析法的分类:掌握直接滴定法及相关化学反应必须具备的条件。间接滴定法及相关化学反应的特点, 直接法配制标准溶液和间接法配制标准溶液的物质必须具备的条件,间接法配制标准溶液,物质的量浓度、滴定度:掌握滴定分析结果的计算,利用被测组分的物质的量nA ,与滴定剂的物质的量nB的关系计算相关的物质的量,量溶度、体积和被测组分质量分数等的计算。
难点
本文有三方面,一是间接法配制标准溶液;二是涉及滴定度的综合计算;三是间接法滴定中涉及多个反应的相关计算。
3.2间接法配制标准溶液
直接法配制标准溶液比较好理解,但是间接法配制标准溶液往往掌握不好。间接法配制标准溶液的方法是,首先粗略地称取一定量物质或量取一定量体积的溶液,将其配制成一种近似于所需浓度的溶液,燃后用基准备物或已经用基准物标定过的标准溶液来标定它的准确浓度。例如0.lmol·L-1 HCI和0.lmol·L-1NaOH标准溶液浓度的配制与标定。
(1)0.lmol·L-1HCI 标准溶液浓度的配副与标定
浓盐酸相对密度为1.19,约12mol·L-1若配制0.1mol·L-1 HCl溶液800ml取浓盐酸多少毫升?
设应称取盐酸x(mL),可根据下式计算。
x×12mol·L-1=800ml×0.1mol·L-1
x=6.7mL
用小量筒取6,7mL浓盐酸,加入纯水,并稀释成800mL, 贮于玻璃细口瓶中,充分摇匀。特标定。
可选用无水碳酸钠作基准物,标定0.1mol·L-1 HCI溶液的准确浓度。欲消耗 HCI 溶液的体积25ml左右,应称取基准物多少克?
根据计算可称取基准物0.13g左右。
(2)0.lmol·L-1NaOH 标准溶液浓度的配制与标定
若配制0.lmol·L-1 NaOH 溶液800ml应称取氯氧化钠多少克?
设应称取氢氧化钠m(g),可根据下式计算。
m=0.1mol·L-1x×800×10-3L×40.01g·mol-1=3.2g
应称取氢氧化钠3.2g,置于烧杯中,用普通天平(±0.1g)称量,称取氧氧化钠3.2g后,立既用800mL去离子水溶解,配制成溶液,贮于具橡皮塞的细口瓶中,充分摇匀,待标定。
可选用邻苯二甲酸氢钾和草酸作基准物,标定0.lmol·L-1 NaOH溶液的准确浓度,今欲用去NaOH溶液的体积25mL左右,应称取基准物各多少克?
以KHC8H4O4作基准物
KHC8H404+Он-== KC8H404﹣+H20
nNaOH=nKHC8H4O4
根据计算可称取邻果二甲酸氢钾基准物0.5g左右。可称取草酸基准物0.16g左右。由此可见,采用邻苯二甲酸氢钾作基准物可减少称量上的相对误差。
一般称取基准物标定标准溶液往往要选取一个称量范围,这个范围怎样选,最好以消耗盐酸或氢氧化钠25一35ml来计算,即标定盐酸时称取无水碳酸钠基准物0.13—0.19g,标定氢氧化钠时称取邻苯二甲酸氢钾基准物0.5~0.7g,称取草酸基准物0.16~0.2lg,由上一章误差分析可知,称取无水碳酸钠以接近0.2g为好。所以用无水碳酸钠作基准物标定盐酸时,以消耗36mL以上的盐酸为好。用草酸作基准物标定氢氧化钠时,以消耗35mL以上的氢氧化钠为好。但是无论是消耗盐酸溶液的体积,还是消耗氢氧化钠溶液的体积,绝不能超过50ml。由于邻苯二甲酸氧钾的分子量较大,所以取25一35mL.的相应计算值时,称量范围为0.5—0.7g。因而在称量误差范围内,不需要考虑称量误差的问题,一般来说,称量范围的确定与称量误差的关系是不容疏忽的。
根据符合称量误差的基准物的质量和消耗的定剂的体积(符合误差要求),从而可计算出标准洛液的浓度。
3.3物质的量浓度
物质B的物质的量浓度,简称B的浓度,以国际符号CB细表示,它与物质的量和溶液的体积的关系如下: CB =πB/V
CB的定义为;单位体积溶被所含溶质的物质的量,单位为摩·升-¹.
物质B的物质的量nB与物质B的质量mB的关系为:nB=mB/MB
由此可见,通过物质的量浓度与相关因素的关系,很容易将某物质的量、溶液的体积、该物质的质量和该物质的摩尔质量联系起来,只要条件充足,即可对某一方面进行求解。
3.4滴定度
滴定度是生产部门常用的计算方法,可使计算方便.在实际应用中滴定度主要有两种表示方法。
①每毫升标准溶液相当的被测组分的质量,用T(被测物/滴定剂)表示。单位克·毫升-¹。
Tfe/k2cr2o7=0.006702g·mL-¹
即表示1mL K2Cr2O7溶液相当于0.006702g铁。
②每毫升标准溶液中所含溶质的质量,用TM表示,单位克·毫升-¹.
如 TI₂ =0.01266g·mL-¹ ,即表示1mL标准碘溶液含碘0.01266g.
3.5滴定分析结果的计算
滴定分析结果计算的依据;当滴定到化学计量点时,滴定剂与被测组分的物质的量之间的关系恰好符合其化学反应所表示的化学计量关系。
3.5.1在直接滴定法中的计算
设被测组分A与滴定剂B间的反应为aA+bB==cC+dD
当滴定到化学计量点时, a(mol)A恰好与b(mol)B作用完全,即nA:nB=a:b 故nA=a/b nB nB=b/a n A
3.5.2在间接滴定法中的计算
在间接滴定法中滴定分析结果的计算比直接法复杂一些,计算过程中往往会出错误。在间接滴定法中涉及多个反应,要想计算不出错误其最关键点是,应从这些反应中找出实际参加反应物质的物质的量之间的关系。
示例1:在酸性溶液中以KBrO3,为基准物标定Na2S2o3溶液时反应分两步进行:
首先,与过量的KI反应析出I2:
ВHO3- +6I- +6H﹢==3I2+ЗН2O+Br-
然后用Na2S2O3溶液为滴定剂,滴定析出的I2:
I2+2S2O²₃-==2I﹣+S4O²6-
由两个反应分析可知,在反应(1)中1mol KBrO3生成3mol I2 ,在反应(2)中1mol I2和2mol Na2S2O3反应,由反应(1)与反应(2)知,1mol KBrO3相当于和6mol Na2S2O3作用,KBrO3与Na2S2O3之间物质的量的关系是1:6,即
nkBrO3:nNa2S2O3=1:6 nNa2S2O3=6nKBrO3
示例2:用酸碱滴定法测定磷
在硝酸介质中,磷酸与钼酸铵反应,生成黄色钼酸铵沉淀:
РO³4- +12MoO²4- +2NH4﹢ +25H﹢≒(NH4)₂H[Рмо12O40]·H2O↓+11Н2O
沉淀过滤之后,用水洗涤,然后将沉淀溶解于定量且过量的NaOH标准溶液中,溶解反应为:
(NH4)2H[Рмо12O40]·H2O+27он- → PO³4- +12MoO²4- +2NH3+16H2O
过量的NaOH再用HNO3标准溶液返滴定,至酚酞恰好退色为终点(pH≈8),这时,有以下反应设生:
Он-(过剩的NaOН)+H﹢≒H2O
PO³4- +H﹢≒HPO²4-
2NH3+2H+≒2NH4﹢
1mol(NH4)2H[PMo12O40]·H20→27mol NaOН
用HNO3返滴定至pH ~8时
1mol PO³4-≌1mol HPO²4-≌1mol HNo3
2mol No3-≌2mol NH4﹢≌2mol HNo3
所以, 1mol(NH4)2H [PMo12O40]·H20→27-3=24(mol) NaOH nPO³4-=1/24nNaOH
示例3:用KMnO4法测定Ca2﹢,经过如下几步:
C2O²4- H﹢ MnO4-
Ca²﹢-------→CaC2O4↓---→HC204--------→2CO2
其反应为
Ca2﹢﹢C2O²4-==CaC2O4↓
5C2O²4- +2MnO4-﹢16H﹢==2Mn²﹢﹢10CO2↑﹢8H2O
可见Ca2﹢与C2O²4-的反应摩尔比是1:1,而C2O²4-与KMnO4是按5:2的摩尔比相互反应的,故nCa=5/2 nKMnO4
3.5.3被测组分质量分数的计算
被测组分在试样中的质量分数wA为WA=m/㎡×100%
式中 m一被测组分的质量;
ms一称取试样的质量.
在滴定分析中,被测组分的nA可由下式求得
nA=a/b nB=a/b CB·VB
又知
nA=mA/MA
即可求得被测组分的质量mA:
于是
a/b CB VB MA
wA=----------------------×100%
ms
式(3—8)为定量分析中计算被测组分的质量分数的一般通式。通过此式建立了5个物理量之间的关系,即wA、CB、VB 、MA、ms 的关系,只要条件满足即可以求得其中某一个所需要的值。同时还可求得mA。








.jpg)