




清洗剂的组成
清洗剂中包括溶剂、酸或碱、氧化剂或还原剂、表面活性剂、缓 蚀剂和钝化剂以及助剂等。
.jpg)
3.4.1溶剂
溶剂是指那些能把清洗剂中其他组分均匀分散的液态物质,它包括水及非水溶剂。溶剂在污垢溶解、分散或与基体剥离过程中不生成具有确定化学组成的新物质。
(1) 水在工业清洗中,水既用于溶解清洗剂中其他组分,又是许多污垢的溶剂。在清洗中,凡是可以用水除去污垢的场合,就不用非水溶剂及其他添加剂。
(2)非水溶剂,非水溶剂指液态有机化合物, 如烃、卤代烃、醇、醚、酮、酯、酚或其混合物,主要用于溶解有机污垢(如油垢或有机污迹等)。其中一些溶剂可以与水混合互溶。例如醇类溶剂(如乙醇、异丙醇、乙二醇等)、醚类溶剂等。这些溶剂可以与水混合制备性能独特的半水基清洗剂。不溶于水的有机溶剂包括烃类溶剂和硅酮(聚硅氧烷,下同)溶剂这些溶剂是ODS (Ozone Depleting Substances, 消耗臭氧层物质)替代溶剂中的重要品种,在精密清洗中有着广泛的应用。另外,有些卤代烃当溶剂可以替代ODS溶剂,也可以配成半水基形式。但是,因为它们不溶于水,需要加入表面活性剂,或加入醇类、醚类、酮类等可溶于水的有机助溶剂。
3. 4.2 清洗主剂酸或碱
酸洗的作用是溶解以碳酸盐和金属氧化物为主的污垢,是借助与污垢发生酸、碱反应,使污垢转变为可溶解或易于分散的状态。但是对新建锅炉和含硫酸盐垢的锅炉,首先需要碱洗。
3.4.2.1 碱洗(碱煮)剂
碱洗主剂的作用如下。
NaOH:提供强碱性,去油;
Na₃PO₄:保持清洗剂碱性,可与Ca²+、Mg²+等离子生成沉淀,降低水的硬度;
Na2CO₃:保持清洗剂碱性,可与Ca²+、Mg²+等离子生成沉淀,降低水的硬度,也可使不被酸溶解的硫酸盐转化为可溶解的碳酸盐。
锅炉在清洗过程中有三种情况需要碱煮。
①新锅炉启用之前需要碱煮除油。因为在制造和安装锅炉的过程中需涂抹油性防锈剂,该油脂在锅炉运行中容易起泡沫,启用之前必须将油脂去除。
②酸洗之前需要碱素。因为锅炉表面的油脂妨碍清洗液与水垢接触,所以在酸洗之前需要碱煮除油和去除部分硅化物,改善水垢表面的润湿性和松动某些致密的垢层,给酸洗创造有利的条件。碱煮去除硅化物的反应式如下。
SiO₂ + 2NaOH→Na₂SiO₃+H₂O
SiO₂+Na₂CO₃→-Na₂SiO₃+CO₂↑
③水垢类型的转化。对用酸不能溶解松动的硬质水垢(如硫酸盐等)可在高温下与碱液作用,发生转化,使硬垢疏松或脱落。
碱洗目的:用高强度碱液,以软化、松动、乳化及分散沉积物有时添加一些表面活性剂以增加碱煮效果。常用于去除锅炉的油性污垢和硅酸盐垢。碱洗是在一定温度下使碱液循环进行,时间一般为6~12h,根据情况也可以延长。
3.4.2.2无机酸清洗剂
(1)无机酸清洗主剂的优缺点优点: 溶解力强,清洗效果好,费用低。缺点:即使有缓蚀剂存在的情况下,对金属材料的腐蚀性仍很大,易产生氢脆和应力腐蚀,并在清洗过程中产生大量酸雾而造成环境污染。
(2)无机酸清洗主剂的去污原理
①去除铁锈垢原理:
6HCl+Fe₂O₃→2FeCl₃+3H₂O
2HCI+ FeO→FeCl₂+H₂O
HF+Fe₂O₃→[FeFy](y¯³)¯+H₂O
②去除碳酸盐原理:
2HCI+ CaCO₃(MgCO₃ )→CaCl₂(MgCI₂)+CO₂↑+H₂O
③去硅垢原理:
硅氧化物(或硅酸盐)+HF→[SiF₆]²¯+H₂O
(3)几种常用的无机酸洗主剂
①盐酸(HCI) 盐酸的优点是能快速溶解铁氧化物、碳酸盐。其效果优于其他无机酸。清洗工艺简单,有剥离作用,溶垢能力强,工效高,效果好,稀溶液毒性小,酸洗后表面状态良好,渗氢量少,金属的氢脆敏感生小,而且货源充足。此外,其反应产物氯化铁或氯化钙的溶解度大,无酸洗残渣,所以至今仍是应用最广的酸洗主剂。可用于碳钢、黄铜、紫铜和其他铜合金材料的设备清洗。费用低,广泛用于清洗锅炉、各种反应设备及换热器等。
缺点:盐酸对金属的腐蚀性很强,超过40℃时易挥发、产生酸雾。为防止腐蚀,必须加入一定量的缓蚀剂。另一方面,不适合用于清洗硅酸盐垢和直接用于清洗硫酸盐垢。
清洗剂中HCI含量一般为5%~15%,必须与缓蚀剂配合使用,清洗温一般低于60°C。
盐酸酸洗缓蚀剂应用性能评价指标及浸泡腐蚀试验方法见DL/T523一93。试验条件: 5%HCI+0.3%缓蚀剂,在(55士2)℃温度条件下浸泡6h, 钢材为20钢,酸液体积与试样表面积之比为15mL: 1cm²。静态腐蚀速率<0.6g/(m²●h)为优等,0.6~1.0g/(m²●h)为良,1.1~2.5g/(m²●h) 合格,>2.5g/(m²●h)为不合格,缓蚀效率>96%为合格。
盐酸酸洗缓蚀剂的生产厂家和注册品牌很多,如Lan-826多用酸洗缓蚀剂、TH-10盐酸缓蚀剂、TPRI-1型盐酸缓蚀剂、JA-IA锅炉盐酸酸洗缓个剂等。
②氢氟酸(HF)氢氟酸是一种弱无机酸。氬氟酸的优点是常温下清洗硅垢和铁垢有特效,溶解氧化物的速度快,效率高;可用来清洗奥氏体钢等多种钢材基质的部件,这一点优于盐酸;使用含量较低,通常为1%~2%;使用温度低,废液处理简单,但不可忽视。
缺点:在空气中挥发,其蒸气具有强烈的腐蚀性及毒性,价格高,对含铬合金钢的腐蚀速率较高。对缓蚀剂不仅要求缓蚀性能高,还需要较强的酸雾抑制能力。氢氟酸可以与缓蚀剂|IMC-5配合使用。
氢氟酸不单独使用,一般与盐酸、硝酸或氟化物等复合使用。
③其他无机酸
a.硝酸一种强氧化酸,对一般的有机缓蚀剂具有破坏和分解作用,且缓蚀剂的分解产物在某些情况下还有加剧腐蚀的作用。低浓度硝酸可腐蚀大多数金属,但是与缓蚀剂(Lan-5、 Lan-826) 配合清洗不锈钢、碳钢或铜表面污垢时,其腐蚀速率很低;高浓度硝酸对金属不腐蚀,有钝化作用。硝酸单独使用不多,与其他酸( 盐酸、氢氟酸)配合使用效果比较理想。硝酸的还原产物(氮氧化物)对环境有污染。
b.硫酸一种强酸,浓硫酸对金属有氧化、钝化作用,稀硫酸对多数金属有腐蚀作用。由于金属的硫酸盐的溶解度都较小,所以单独使用不多,可与其他酸配合使用。硫酸密度大,浓硫酸的物质的量浓度高,相同质量的酸液所占体积较小,运输成本较低,洗一台锅炉所用工业硫酸的体积仅为盐酸的1/4。浓硫酸对钢铁几乎不腐蚀。
硫酸酸洗缓蚀剂可用天津若丁、硫代乙酰苯胺、DA-6 (苯胺与乌洛托品的反应物)。
3. 4.2.3 有机酸清洗剂
化学清洗剂中常用的有机酸包括柠檬酸、EDTA、甲酸、氨基酸、羟基乙酸、草酸等。
(1)有机酸清洗剂的优缺点优点:对金属基体的腐蚀作用小,清洗效果好;缺点:作用速率慢,成本高。
(2) 有机酸清洗主剂的去污原理有机酸主要是利用其络合(螯合)能力,同时用其酸性或氧化性,将污垢浸润、剥离、分散、溶解。
(3)几种常用的有机酸洗主剂
①EDTA (乙二胺四乙酸,H₄Y)面EDTA去除铁锈的原理:铁锈 (FeO、Fe₂O₃、Fe₃O₄) 与H₂Y²¯发生反应生成FeY²¯、FeY¯和H₂O。清洗过程中同时存在着电离、水解、络合、中和等多种化学反应,生成稳定的络合物。EDTA二钠盐在pH为5~8时对铁锈的溶解效果很好。特点:pH大于7时,EDTA对金属有钝化作用,所以用其作清洗主剂可以清洗、钝化一步完成,减免了再次用水冲洗、漂洗、钝化等过程,缩短了清洗时间和除盐水的用量。EDTA对氧化铁和铜垢以及钙、镁垢有较强的清洗能力。
缺点:因室温时,EDTA在水中的溶解度仅为0. 03g/100g,为提高其溶解度和清洗效果,需升温到140~160℃,所以其缓蚀剂需用耐高温缓蚀剂。
EDTA清洗缓蚀剂大部分是复配而成的。目前国内常见的EDTA清洗缓蚀剂有MBT、TSX-04、N₂H₄、乌洛托品、YHH-1、Lan-826等。
②柠檬酸(C₆H₈O₇) 柠檬酸是酸洗中应用最早、最多的一种有机酸。它主要是利用与铁离子生成络离子的能力(而不是用它的酸性)来溶解铁的氧化物,柠檬酸本身与铁垢的反应速率较慢,且生成物柠檬酸铁的溶解度较小,易产生沉淀。所以,在用柠檬酸作清洗主剂时,为了生成易溶的络合物,常要在清洗液中加氨水,将溶液pH调至3.5~4.0。
特点:腐蚀性小,无毒,容易保存和运输,安全性好,清洗液不易形成沉渣或悬浮物,避免了管道的堵塞,自身具有缓蚀功能,对碳钢基体的缓蚀效率可超过99%。
缺点:试剂昂贵,只能清除铁垢,而且能力比盐酸小。对铜垢、钙镁和硅化物水垢的溶解能力差,清洗时要求一定的流速和较高的温度,也必须选择比较耐高温的缓蚀剂。
另外,选择柠檬酸酸洗时,由于柠檬酸酸洗时的温度高、循环速度快,因此在选择柠檬酸酸洗时,缓蚀剂必须适用这种条件。常用的柠檬酸酸洗缓蚀剂有仿若丁-31A、乌洛托品、硫脲、邻二甲苯硫脲、若丁、工业二甲苯硫脲等
仿若丁-31A的主要组分为二乙基硫脲、烷基吡啶硫酸盐、苯腈、硫氰酸铵、异硫氰酸苯酯等。
有机酸洗液主要用于锅炉系统的清洗,可以有效地去除晶间腐蚀和闭塞区腐蚀产生的垢物,从而避免发生爆管之类的安全事故。上述铁基材料的酸洗缓蚀剂绝大多数属于含氧、硫、氮、磷的有机化合物,主要包括胺类、硫脲类、醛酮类,其作用机理属于吸附缓蚀。
③氨基磺酸氨基磺酸是一种粉末状中等酸性的无机酸。
优点:不易挥发,在水中的溶解性好,不会发生盐类析出沉淀的现象,去除水垢及氧化铁的能力较强,对金属的腐蚀性相对较小,常被用于清洗钢铁、铜、不锈钢、铝、锌等金属和陶瓷基体表面的铁锈和水垢。与多数金属形成的盐在水中的溶解度都较高。适用于清洗钙、镁的碳酸盐和氢氧化物,不会在清洗液中产生沉淀。其缺点是对铁垢的作用较慢,需要避免与强氧化剂、强碱接触。
氨基磺酸酸洗缓蚀剂主要有Lan-826、O'Bhibit (二丁基硫脲)、LN500系列。此外还有二丙炔基硫醚、丙炔醇、季铵盐、乙基硫脲和十二胺等,现国内常使用的氨基磺酸酸洗缓蚀剂为TPRI-7型缓蚀剂,通过对各种材质的静态腐蚀速率试验[温度(55士5)°C、 氨基磺酸5% + TPRI-7型缓蚀剂0.4%、循环酸洗时间为2h],结果表明,缓蚀剂的腐蚀速率控制在0.6g/(m²·h)左右,效果很好。
TPRI-7型氨基磺酸缓蚀剂用于碳钢、低合金钢、高合金钢为材质的超高压、亚临界电站锅炉的氨基磺酸酸洗防腐,也可以用于铜材质的凝汽器的清洗防腐等。
④羟基乙酸其优点是对碱土金属类的污垢有较好的溶解能力,与钙、镁等化合物作用较为剧烈;几乎不挥发,腐蚀性低,不易燃,无溴、毒性低,生物分解性强,水溶性好;由于无氯离子,可用于奥氏体钢材的清洗,对于已严重结垢并且大面积产生晶间腐蚀的锅炉来说,使用EDTA和柠檬酸清洗的除垢率都难以达到90%以.上,而采用盐酸又会加重晶间腐蚀,这时可以考虑采用甲酸/羟基乙酸的混酸清洗。
表1-1 列出了不同酸钢铁的溶解腐蚀的能力。
.jpg)
3.4.2.4碱清洗剂
碱洗的作用是除油(尤其对新建锅炉)和将钙、镁的硫酸盐转化成可被酸溶解的碳酸盐。常用的碱洗主剂主要有NaOH、Na₂CO₃、Na₃PO₄、Na₂HO₄、NaH₂PO₄,必要时加入表面活性剂。
碱性清洗剂中包括碱洗主剂(碱或碱式盐)表面活性剂和助剂等。
3.4.2.5氧化-还原剂
借助与污垢发生氧化反应、还原反应而清除污垢的制剂称为清洗用氧化剂或还原剂。
氧化剂用以清除有还原性的污垢,如许多有机污垢等。
还原剂用于清除有氧化性的污垢,如金属氧化物为主的锈垢。另外,由于对金属基体的污垢进行酸洗的过程中会产生大量的Fe³+,由电化学原理可以估算由Fe³+对金属基体腐蚀的推动力。
两个标准电极电势如下。
φFe³+/Fe²+=0. 77V;φFe²+/Fe=-0. 41V
该反应的吉布斯函数变为:
△Gθ=-2FE=2X96485x[0.77-(-0.41)]x10¯³=一227.7kJ/mol
由上式可知,Fe³+对金属基体腐蚀的推动力大于铜离子对活泼金属锌的腐蚀(其标准吉布斯函数变为212. 3kJ/mol),说明Fe³+对Fe具有很强的腐蚀作用。所以在酸洗过程中,如果Fe³+的浓度较高时(> 500mg/L),必须加入还原剂,以降低Fe³+的浓度,减少对金属基体的腐蚀。
3.4.3 表面活性剂
表面活性剂分子中同时具有亲水的极性基团与亲油的非极性基团,当它的加入量很少时,即能大大降低溶液的表面张力,并且具有洗涤、增溶、乳化、分散等作用。
通常根据表面活性剂在溶剂中的电离状态及亲水基团的离子类型将其分为阴离子表面活性剂、阳离子表面活性剂、两性表面活性剂及非离子表面活性剂等。前三类为离子型表面活性剂。
3.4.3.1阴离子型表面活性剂
阴离子型表面活性剂在水中电离出的阴离子部分起活性作用,如:
烷基羧酸钠 R一COONa→RCOO¯+Na+
烷基硝酸钠 R-NO₃Na-→RNO₃¯ +Na+
烷基硫酸钠 R-O-SO₃Na→ROSO₃+Na+
这类活性剂主要用作清洗剂、 起泡剂、乳化剂等。
3.4.3.2阳离子型表面活性剂
阳离子型表面活性剂在水中电离出的阳离子部分起活性作用,如十五烷基三甲基氯化铵。
[C₁₂H₂₅-N(CH₃)₃]CI→[C₁₂H₂₅N(CH₃)₃]+CI¯
季铵盐、吡啶盐等阳离子表面活性剂多数用于缓蚀、防腐、杀菌及抗静电等方面。
3.4.3.3两性表面活性剂
两性表面活性剂在水中电离出两种离子都起活性作用,如烷基二甲胺丙酸内盐,其结构式如下。
R--N+CH₃/CH₃-CH₂CH₂COO¯
这类活性剂的性能更全面,比单独阴离子或阳离子更好,用途广泛,有很多特殊的应用,还用于和其他类型活性剂复配,效果更优。特别是作用柔和、毒性小,常用于乳化剂、铺展剂、杀菌剂、防腐剂、油漆颇料分散剂及抗静电剂等。
3.4.3.4 非离子型表面活性剂
非离子表面活性剂在水中不电离,亲水基由醚基和羟基或聚氧乙烯基构成。
①脂肪酸聚氧乙烯酯RCOO(CH₂CH₂O)nH如聚氧乙烯油脂酸、 硬脂酸酯等,这类表面活性剂乳化性能好,但起泡性能较差。
②聚氧乙烯烷基酰胺RCONH(C₂H₄O)nH及RCON(C₂H₄OH)₂该类表面活性剂有较强的起泡和稳定作用,黏度大,主要用于洗涤剂、稳泡剂、增黏剂、乳化剂、防腐剂及干洗剂等。
③多醇表面活性剂自多羟基物与脂肪酸生成的酯,如硬脂酸、月桂酸与甘油、蔗糖、失水山梨醇等的酯,它除具有非离子的一般性能外,突出特点是无毒、无臭、无味,主要用于低泡的洗涤剂及食品工业中的乳化剂。
3.4.4缓蚀剂一一化学清洗技术的核心
化学清洗技术是一种廉价、快速清除基体表面的污垢并恢复其原有的功能方法,它通过化学反应将基体表面上的难溶污垢溶解或剥离。为了清除污垢和腐蚀产物,常采用酸,而且常用强酸作清洗主剂,而酸会在溶解、清除污垢的同时腐蚀金属基体。采用缓蚀剂是化学清洗中防腐的重要方法, 缓蚀剂是化学清洗技术的核心。
3.4.4.1酸腐蚀的原因
酸腐蚀包括化学腐蚀和电化学腐蚀。
(1)化学腐蚀这种腐蚀是酸直接作用于金属,发生化学反应。在酸洗过程中,尤其是无机强酸对金属设备有很强的化学腐蚀作用,这种腐蚀的程度与酸的种类及基体金属的活泼性有关。同一金属对于不同的酸的反应活性不同;同样,同一种酸对不同金属的反应活性也不同。
①硫酸稀H₂SO₄易和钢铁反应;而60%以上的H₂SO₄,室温下在钢铁表面形成钝化膜而使钢铁耐蚀; 93%以上的H₂SO₄,即使煮沸也几呼不腐蚀钢铁。Pb 和钢铁相反,可溶于浓H₂SO₄,而对稀H₂SO₄有良好的耐蚀性。Al易溶于10%的H₂SO₄中,但对80%以上的H₂SO₄有耐蚀性.
②盐酸Mg、Zn、Cr、 Fe易被HCI腐蚀;Pb对20%以下的HCI有耐蚀性: Sn、Ni在常温下对稀HCI有耐蚀性,而在氧化条件下易被 18/8Cr-Ni不锈钢可被HCI腐蚀;:Cu一般不被盐酸所腐蚀,Cu可被氧化性酸(如硝酸)所腐蚀。
③硝酸HNO₃对多数金属有腐蚀性,但因其具有很强的氧化性,可在一些金属表面形成致密的氧化膜,保护金属。Sn、Pb可被HNO₃腐蚀;铬与铝类似,在冷、浓HNO₃中形成致密氧化膜钝化,不被HNO₃腐蚀;钢铁在浓HNO₃中生成氧化膜有良好耐蚀性,但易为稀HNO₃腐蚀;锌、镍、铜对HNO₃无耐蚀性。
④草酸(H₂C₂O₄)草酸虽然是弱酸,但对金属也有腐蚀作用,钢铁在常温下可被草酸腐蚀,但在加热时则能生成草酸铁保护膜,阻止腐蚀继续进行。铝、镍、铜、不锈钢对草酸有较好的耐蚀性。另外,金属和酸反应生成的氢会造成金属设备的氢脆腐蚀,氢气还会带出大量的酸性气体,造成劳动条件的恶化。因此在清洗金属基体时酸性清洗剂中一定要添加缓蚀剂。
氢脆也是对金属进行化学清洗过程中经常发生的一种化学腐蚀,它是由于金属吸收了原子氢而使其变脆(发生脆性断裂)的现象。氢原子的生成过程如下式所示
酸洗反应: FexOy,(铁氧化物) +HCI→FeCl₂ (或FeCl₃)+H₂O
酸洗副反应: Fe (基体)+2H+=Fe²+2H (原子氢)
高温时: Fe+H₂O (高温水蒸FeO+2H (原子氢)
原子氢被金属吸收即可发生氢脆。
(2)电化学腐蚀这种腐蚀是金属基体通过电化学反应而被腐蚀。电化学腐蚀有析氢腐蚀和吸氧腐蚀,化学酸洗过程主要发生析氢腐蚀,当使用弱酸性或中性清洗剂,有空气(氧气)。存在时发生吸氧腐蚀。另外,有时也需要考虑表面活性剂的腐蚀性。一般说来,表面活性剂对于钢件有防腐作用,但有些却可加速金属生锈。因此在清洗剂中,要考虑表面活性剂与缓蚀剂的搭配,以改善其防腐蚀性能。
缓蚀剂种类繁多,缓蚀机理各异,在这里仅介绍常用的水溶性缓蚀剂及其作用机理。
3.4.4.2水溶性缓蚀剂作用机理
水溶性缓蚀剂的作用机理都是在金属表面生成稳定的保护膜,其膜的类型可分为以下几种情况。
(1)生成致密氧化膜这类缓蚀剂具有较强的氧化性,能够在金属表面生成不溶性的致密、附着力强的氧化物薄膜,当氧化膜达到一定厚度(如5~10nm),阳极氧化反应的速率减慢,金属被钝化,腐蚀速率大大降低,从而减缓或阻止了金属被腐蚀的过程,起到缓蚀的作用。此类缓蚀剂是阳极型的,值得注意的是这些缓蚀剂当用量不足时,不仅不能缓蚀,反而加速腐蚀。因为,若不能使金属全部钝化,腐蚀便集中于这些尚未钝化的区域内,此时钝化区可作阴极(而阴极面积较大),未钝化区作为阳极(较小),造成小阳极对大阴极,阳极区电流密度增大,使其发生剧烈的电化学腐蚀,还会引起严重的深度腐蚀。这类缓蚀剂又称为“危险性缓蚀剂”。
属于这类缓蚀剂的化合物如下。
对Fe: NaNO₂、Ke₂Cr₂O₇、 K₂CrO₄、Na₂WO₄、Na₂Mo₄等。
对AI:K₂Cr₂O₇、K₂CrO₄、KMnO₄等。
(2)生成难溶的保护膜
①生成无机难溶的保护膜无机缓蚀剂分子能与阳极腐蚀溶解下来的金属离子相互作用,形成难溶的盐类保护膜,覆盖于金属表面上。难溶沉 淀膜厚度一般都比较厚 (为10~ 100nm),膜的致密性和附着力均不如(1)类钝化膜,防腐效果相对较差,但可以减缓、阻滞腐蚀过程的进一步发生。 例如,磷酸盐缓蚀剂(Na₂HPO₄或Na₃PO₄)能与Fe³+生成不溶性的γ-Fe₂O₃和FePO₄·2H₂O的混合物。此类缓蚀剂通常和去垢剂合并使用于中性水介质,以防止金属腐蚀或表面结垢。属于这类缓蚀剂的化合物如下。
对Fe: NaOH、Na₂CO₃、Na₃PO₄、Na₂HPO₄、( NaPO₃)₆、Na₂SiO₃、 CH₃COONa等。
对AI: Na₂SiO₃、Na₂HPO₄等。
这类缓蚀剂有一个值得注意的特点是介质中氧气的存在对缓蚀剂有加强作用。例如:苯甲酸钠,有氧时生成不溶性的三价铁盐,可以保护金属;没有氧时,则生成二价可溶性铁盐。
②生成有机难溶的保护膜或难溶的络合物覆盖膜缓蚀剂分子能与金属离子生成难溶的络合物薄膜,从而阻止了金属的溶解,起到缓蚀作用。 例如:苯并三氮唑对铜的缓蚀,一般认为铜取代了苯并三氮唑分子中的H原子,以共价键连接,同时与另一个苯并三氮唑分子上的氮原子的孤对电子以络合键的形式连接,形成了不溶性的聚合络合物,其结构为:
.jpg)
属于这类缓蚀剂的化合物还有苯甲酸钠 (对钢),以及含有N、O、S元素的有机杂环类化合物。
(3)生成吸附膜这类缓蚀剂能吸附在金属表面, 改变金属表面性后从而抑制腐蚀。它们一-般是混合型有机化合物缓蚀剂,如胺类、硫醇、硫脲、吡啶衍生物、苯胺衍生物、环状亚胺等。为了能形成良好的吸附膜,金属必须有洁净的表面,所以在酸性介质中往往比在中性介质中更多地采用这类缓蚀剂。
根据分子吸附作用力的性质,吸附型缓蚀剂的缓蚀机理是其在金属表面发生物理吸附和化学吸附,主要以化学吸附为主。一方面氧、氮、硫、磷等元素含有孤对电子,它们在有机化合物中都以极性基团的形式存在, 如-NH₂ (氮基)、N (叔胺或杂环氮化合物)、一S一(硫醚)、一SH(巯基)等,另一方面铁、铜等过渡金属由于d电子轨道未填满可以作为电子受体,这些元素与金属元素络合结合,形成牢固的化学吸附层。
此外双键、三键、苯环也可以通过π键的作用在金属表面发生化学吸附。
目前常将缨蚀剂复配使用,一般是将两种或多种缓蚀剂共同加入清洗液中,利用各自的优势,减少原有的局限性。通常把阳极和阴极缓蚀剂结合使用,也可使用非极性基团的有机物。这种复配而成的缓蚀剂的效率比单一组分要大很多,称之为协同作用。协同作用的发现,使缓蚀剂的研究和应用提高到一个新的水平,但其作用机理有待进一步研究。此外,在缓蚀剂中添加表面活性剂也是近年来研究的方向,其缓蚀机理是由于表面活性剂具有增溶、乳化、吸附、分散等性能,从而有效地提高缓蚀剂的缓蚀效率。
3.4.4.3 缓蚀剂分类
可从不同的角度对缓蚀剂进行分类。
(1) 按用途分类缓蚀剂按用途可分为单功能型和多功能型。
①单功能型缓蚀剂这种缓蚀剂只含有某一种基团(如氨水、乌洛托品),它们仅对钢铁类黑色金属材料制品具有缓蚀性能,而对多种有色金属,或是两种金属的连接处,其缓蚀效果不佳,有时对多种金属组合件机械制品中的铜、锌、镉等有色金属部件,需要采取隔离保护措施甚至放弃使用缓蚀剂技术。
②多功能型缓蚀剂它们的分子中含有两个或两个以上的缓蚀基团,如苯并三氮唑(BTA)及其衍生物、三氮唑系列化合物、邻硝基化合物、流基苯并噻唑(MBT)、肟类化合物等缓蚀剂。羧基喹啉中就有-OH、-N两个缓蚀基团,这些基团不仅能对铜及铜合金具有良好的缓蚀性能,而且铁、锌、镉、银等金属具有良好的缓蚀效果。
(2)根据化学成分分类气 可分为无机缓蚀剂、有机缓蚀剂、聚合物类蚀剂。
①无机缓蚀剂主要包括铬酸盐、亚硝酸盐、硅酸盐、聚磷酸盐等。
②有机缓蚀剂主要包括膦酸 (盐)、膦羧酸、巯基苯并噻唑、苯并氮唑、磺化木质素等一些含氮氧化合物的杂环化合物。
③聚合物类缓蚀剂包括一些低聚物的高分子化合物。
(3)根据电化学腐蚀的控制行为分类 可分为阳极型缓蚀剂、阴极型缓蚀剂和混合型缓蚀剂。
① 阳极型缓蚀剂包括无机强氧化剂,如铬酸盐、亚硝酸盐等。其作用是在金属表面阳极区与金属离子生成致密的、附着力强的氧化物保护腹抑制金属溶解。阳极型缓蚀剂被称为“危险性缓蚀剂”,因为一旦剂量不足,未覆盖区将会被加速孔蚀。因此,应用时不能低于缓蚀剂在该条件的“危险浓度”。
这类缓蚀剂同样可以减缓化学腐蚀的侵袭。
②阴极型缓蚀剂可抑制电化学阴极反应的化学药剂, 如碳酸盐、磷酸盐等。其作用是与金属反应,在阴极生成沉积保护膜。这类缓蚀剂在用量不足时不会加速腐蚀,故又有“安全缓蚀剂”之称。
③混合型缓蚀剂某些含氮、硫或羟基的、具有表面活性的有机缓蚀剂,其分子中有两种极性相反的基团,能吸附在金属表面形成单分子吸附膜。它们既能在阳极成膜,也能在阴极成膜,阻止水与水中溶解氧向金属表面的扩散,起到缓蚀作用。巯基苯并噻唑、苯并三氮唑、十六烷胺等属于此类缓蚀剂。在酸性介质中往往相对较多地采用这类缓蚀剂。
由于缓蚀剂的缓蚀机理在于成膜,故迅速在金属表面上形成一层密实的膜(氧化膜、沉淀膜、吸附膜)是获得缓蚀成功的关键。为达此目的,缓蚀剂的浓度应该足够高,当膜形成后,再降至相应的浓度;为了密实,金属表面应十分清洁,为此,成膜前对金属表面进行化学清洗(除油、除污和除垢)是必不可少的。
3.4.4.4缓蚀剂的副作用
铬(VI)酸盐(缓蚀剂)有毒,虽然它对循环冷却水中的菌、藻等有害微生物有杀灭作用,但对环境造成污染。磷酸盐是水中微生物的营养源,它的排放会造成水体富营养化,对环境造成污染:钼酸盐等应用成本高;亚硝酸盐致癌;硅酸盐缓蚀效果差;锌盐对水体中的生物造成威胁。因为许多 缓蚀剂具有副作用,人们对绿色有机缓蚀剂的开发和应用表现出浓厚的兴趣。
3.4.4.5缓蚀剂的特点
防止金属基体腐蚀可以采取电化学保护等方法,但与其相比,用缓蚀剂法有如下特点。
①用缓蚀剂无需特殊的附加设施,但为了有效和精确地控制缓蚀剂用量,近年来也常采用全自动的缓蚀剂加料装置。
②不改变金属基体本质,也无需改变金属外表,故缓蚀剂非常适合于设备的化学清洗。
③由于用量少,添加缓蚀剂后,介质性质基本不变,故本方法也适用于城市供水管道防锈,石油天然气输送、储存和精炼等场合的设备管道防腐蚀。
需要注意的是缓蚀剂具有选择性。
3.4.4.6一些常用的缓蚀剂
(1) 几种无机缓蚀剂
①亚硝酸盐它易溶于水,一 般配成2%~20%水溶液,并常加入0.3%~0.6%的Na₂CO₃调节pH在8~10之间。它对黑色金属(钢、铁、锡合金等)缓蚀效果好,而对于Cu等有色金属则无效。NaNO₂之所以能起到缓蚀作用,主要是因为NO₂¯可以使铁氧化并生成高价难溶的氧化物而沉积在金属表面。亚硝酸盐的缓蚀性能极大地依赖于溶液中侵蚀性离子(如CI¯、NO₃¯等)的浓度和它们自身的浓度。当亚硝酸钠浓度低时,它可能促进腐蚀;只有达到一定浓度时,亚硝酸钠才具有好的缓蚀作用。因此,亚硝酸钠属于“危险性缓蚀剂”。
研究发现亚硝酸盐有致癌作用,使其应用受到了限制。近年来,人们着手寻求亚硝酸钠的代用品,并取得了一定的成绩,如苯甲酸钠的芳环上同时引入硝基、溴、碘等的衍生物,可获得与亚硝酸钠相近或优良的防锈效果。属于这一类型的衍生物有:对碘化苯甲酸三乙醇胺、对于氧基苯甲酸钠、3,5-二溴-4-甲氧基苯甲酸钠及二硝基水杨酸等。
②磷酸盐作为水溶液中缓蚀剂的磷酸盐有:磷酸钠、磷酸氢二钠、三聚磷酸钠、六偏磷酸钠等。磷酸氢二钠是很弱的缓蚀剂,浓度增大时则成为腐蚀的促进剂。磷酸钠的缓蚀作用比二钠盐要好,当其浓度增大时, 缓蚀作用明显增加。实验表明,Na₂HPO₄ 对钢、铸铁、铅等防锈有效,但能促进Cu的腐蚀;六偏磷酸钠可作钢、铸铁、铅的缓蚀剂,但对Cu、AI有相反作用。另外,磷酸盐与铬酸盐混合使用,有缓蚀协同效应,pH在6.5~6.0时,效果最佳。
③铬酸盐和重铬酸盐K₂CrO₄、 K₂Cr₂O₇是有色金属通用的水溶性缓蚀剂,对黑色金属也有良好的缓蚀作用。其缓蚀机理一般认为是由于它与 亚铁盐作用生成了难溶的三氧化二铬(Gr₂O₃)与氧化铁(Fe₂O₃、 Fe₃O₄)组成的保护膜。铬酸盐的缓蚀作用与溶液中的其他阴离子(如CI玉So₄²¯、NO₃¯等)有关。这些腐蚀性阴离子的浓度越大,铬酸盐的临界浓度也越大,其中以CI¯的影响为最大。
另外,铬酸盐的保护浓度还与溶液的温度有关,温度升高,保护浓度也增大。例如,20°C时,足以抑制腐蚀的铬酸盐浓度,当温度升高到80°C,已不能满足缓蚀要求,铬酸盐浓度必须提高1~2倍。
近年来,人们研究了大量的有机铬酸盐缓蚀剂,如铬酸氰胺,铬酸的甲胺、二甲胺、异丙胺、丁胺、二环己胺、环己胺盐等。有机铬酸盐的治界保护浓度比铬酸钾低,保护性也好。
④碳酸盐例如碳酸钠 (Na₂CO₃), 白色粉状固体,水溶液呈碱性,可作黑色金属的缓蚀剂,一般不单独使用,常和NaNO₃复配使用,用以请节溶液的pH。
⑤乌洛托品一六亚甲基四胺[(CH₂)₆N₄]无毒无味,作为传统的清洗缓蚀剂,适用于黑色金属在盐酸中的清洗,广泛用于各行业用的蒸汽锅炉和 锅炉热交换器的清洗。其浓度为1.5%时,缓蚀效率出现最大值(> 95%)大于该浓度后,缓蚀效率下降;随着温度升高,乌洛托品的缓蚀作用效果降低。
⑥硅酸盐硅酸盐资源丰富,无毒、价廉、抑菌,是一种“环境友好”的缓蚀剂。例如硅酸钠(Na₂siO₃),俗称水玻璃,是一种碱性水溶性缓蚀剂。它不仅可以保护钢,而且可用于保护铝合金、铜、铅及锡等金属。
a.硅酸钠单独使用硅酸钠的缓蚀能力与其模数有关日(mNa₂O·nSiO₂,m/n即为硅酸钠模数),为2. 0~2.8 (最好为2. 4)时较好,用水将其稀释充分搅拌后静置,保留上层清液可作为防锈液。将除锈去污后的冷铁浸泡在上述溶液中,自然干燥即可,处理后的冷铁可在普通室内保存 1~2个月而不生锈;当添加0.20mg/g的硅酸钠时,铝合金在3.5% NacI溶液中具有较好的缓蚀作用。硅酸钠作为缓蚀剂单独使用成膜慢,所形成的膜有孔隙,易形成硅垢,与其他物质复配使用已成为三种发展趋势。
b.硅酸钠复配使用I缓蚀剂是由硅酸钠、钼酸盐、有机胺复配而成的,主要控制阳极反应的混合抑制型缓蚀剂。加量0.2%时,对G105 钢试片80°C动态腐蚀的缓蚀效率达88. 2%。硅酸钠为主,与聚环氧琥珀酸(PESA)、 苯并三氮唑(BTA)
Zn²+复配使用的缓蚀剂,当四种试剂构成配比为60:40:18:8时显示出较好的协同效应,此时对铜的缓蚀效果好。
硅酸钠与钼酸钠复配后可在材料表面形成完整致密的保护膜层,弥补单一用钼酸钠所形成的膜致密度不够的缺陷,阻止腐蚀E的发生和进行高CI¯浓度环境中,此缓蚀剂仍能有效地阻止CI¯通过膜层向金属表面的迁移,抑制金属的腐蚀。由硅酸钠、钼酸铵和乌洛托品复配的缓蚀剂是冷轧铝板在中的非磷、非铬高效复合型缓蚀剂,缓蚀效率可达99.9%。
有机硅酸钠可抑制阳极反应。甲基硅酸钠、乙烯基硅酸钠Y-氨丙基硅酸钠和聚醚有机二硅酸钠与锌盐均具有良好的协同效应。当与4mg/L的锌盐复配使用时,聚醚有机工硅酸钠的缓蚀效果很好,当药剂溶度为150mg/L时,缓蚀效率可达95.5%。另外,有机硅酸钠结垢性比无机度浓度为酸钠小,聚醚有机二硅酸钠的结垢率仅为4. 36%,而硅酸钠为13. 4%。
对硅酸钠的保护作用机理有两种不同观点:一种认为是不定形的硅凝胶与铁的水化物在金属表面沉积形成保护膜;另一种认为带负电荷的溶胶粒子与带正电荷的铁离子在腐蚀过程开始的位置聚集,并相互作用生成硅酸铁,从而阻滞了阳极腐蚀过程。
有些无机缓蚀剂或其他无机助剂具有双重作用,在发挥积极作用(缓蚀、钝化)的同时,为水体提供了比较充足的无机离子(如碳酸根、硫酸根、磷酸根等或其他阳离子)以利于生成钝化保护膜,但这些离子在一定情况下也形成结垢离子,所以使用时尽可能不要过量。
(2)几种有机缓蚀剂
①苯甲酸钠,苯甲酸钠是一种适应性较广的缓蚀剂。它不是氧化剂,在浓度不足时参与阴极过程,不属于危险缓蚀剂,故不会加速腐蚀。苯甲 酸钠溶于水和醇类,属于水溶性有机缓蚀剂。将其配成1.0% ~1.5%的防锈水,既可阻止钢的锈蚀,也可减缓Cu、Pb的锈蚀,但对AI、Zn、Fe效果较差。
②三乙醇胺N(CH₂CH₂OH)₃]三乙醇胺是一种无色或淡黄色黏稠液体,易溶于水,水溶液呈碱性,常和NaNO₂、苯甲酸钠一起配成防锈水使用,其用量一般为0.5%~10%,实际使用时还略偏高。(般只对钢铁有效,对Cu、Cr、Ni则有加速腐蚀的倾向。
③氨基磺酸适用于碳钢金不锈钢铜、铝、钛等金属材质的酸洗,使用量一般为0.1%,用50~60℃温水溶解,配制酸清洗剂。
④杂环型缓蚀剂罪含O、N、S、P等原子的杂环型缓蚀剂具有多个活性吸附中心(缓蚀基团),对多种金属具有较强的吸附作用并形成稳定的络合物或螯合物;而且分子内或分子间极易形成大量的氢键,而使吸附层增厚,形成阻滞H+接近金属表面的屏障,因而具有多功能、高效性(通过分子内不同极性基团的协同作用)、适应性强(环境的温度和pH变化对其缓蚀性能影响较小、低毒性等优点,属混合型缓蚀剂(既能抑制阴极反应,又能抑制阳极反应)。如吲哚(苯并吡咯C₈H₇N)在10%的HCI溶液中对 碳钢的缓蚀效率高达98%; 4-(N,N-二环已基)氨甲基吗啉(DCHAM),是一种优良的黑色金属缓蚀剂,对铜、铝等有色金属也有较好的防锈能力。
⑤咪唑啉(C₃H₆N₂)、酰胺系列酸洗有机缓蚀剂在用酸清洗金属时,可加入咪唑啉类缓蚀剂,抑制酸对钢材的腐蚀。这类酸洗缓蚀剂应用的前提是清洗主剂为盐酸、硫酸、氨基磺酸,清洗对象的基材为黑色金属。该酸洗缓蚀剂适用于各种型号的高中低压锅炉的酸洗,以及大型设备、管道的酸洗。酸液中,加药量为1%~3%,腐蚀速率<1g/(m²·h)。
将酸洗缓蚀剂按比例加入到稀释好的酸液中,开启循环泵循环清洗。清洗过程中补加酸液时按比例补加酸洗缓蚀剂。
(3)生物缓蚀剂由天然植物制取的酸洗缓蚀剂具有(绿色])无毒、成本低的特点,这类缓蚀剂具有很好的前景。例如由海洋生物提取的聚天冬氨酸(PASP, 无毒)为主要成分复配的金属缓蚀剂在pH处于10以上时能得到较好的缓件效果,可分别与有机磷、钨酸钠、季铵盐、锌盐、铝度盐、氧化淀粉等复配,取得更好的缓蚀效果。
据报道, 由松香行生物、毛发水解产物、单宁以及海带、胡椒、烟莫等提取的有效成分,制备的金属缓蚀剂具有较好的缓蚀效果:从松香中提出的松香胺衍生物、咪唑及其衍生物可作为高稳定性的钢铁用低毒型缓蚀剂代替剧毒的亚硝酸二环已胺;从奶油中提取的吲哚酪酸可对黑色金属进行缓蚀:从茶叶、花椒、果皮、芦苇等天然植物中可成功提取缓蚀剂的有效成分,黄连中的提取物在1mol/L HCI中对Q235钢缓蚀作用高达98%,可以同时抑制碳钢表面腐蚀的阴、阳极反应,是一种优良的天然绿色缓蚀剂。用水蒸气蒸馏法从樟树叶中提取桉叶油,并将其作为盐酸酸洗缓蚀剂的主要成分,制备复合缓蚀剂配方。结果表明,在5%的盐酸溶液中,复配缓蚀剂对碳钢的缓蚀效果良好,缓蚀效率达92%,是一种环境友好型缓蚀剂。这类缓蚀剂具有成本低廉、低毒或无毒等特点。
(4)著名品牌缓蚀剂
①若丁是我国最早的酸洗缓蚀剂之一,由二邻苯酸脲、淀粉、食盐、平平加(或皂角粉)组成。若丁可在金属酸洗过程中减缓盐酸对金属基体的腐蚀,同时抑制酸雾的产生,促进对各种氧化皮、硅酸盐水垢的清洗,具有良好的缓蚀效果,并有抑制钢铁在酸洗过程中吸氢的能力,避免发生“氢脆",同时抑制酸洗过程中Fe³+对金属的腐蚀,使金属不产生孔蚀。
适用于作黑色金属及铜在硫酸、 盐酸、磷酸、氢氟酸、柠檬酸中清洗时添加的缓蚀剂。适用于各种型号的钢铁、不锈钢、铸钢、铜等各种店及其合金部件、组合件特点:若丁性能稳定、操作简单、用量小、效率高、费用小无毒无臭、对环境无污染:对金属基体的腐蚀小、缓蚀效率高,酸洗过程没有酸雾,使用安全。使用量一般为2% ~5% (质量分数)。 酸洗液中盐3%~10% (质量分数), 常温使用,温度不能超过45℃。对碳钢般在蚀效率大于95%。
②Lan-5我国1974年研制的高效硝酸酸洗缓蚀剂,由乌洛胺、硫氰酸钠三种组分按3: 2 :1比例配成,是用硝酸酸洗水垢中使用的一种较理想的缓蚀剂。也可以用于各种浓度的硫酸中,缓蚀效果良好。并可抑制钢铁在酸洗过程中吸氢,避免钢铁发生“氢脆”,同时抑制酸洗过程中Fe³+对金属的腐蚀,使金属不产生孔蚀。适用于碳钢、不锈钢、铜、铝、钛等金属材质及其不同材质的组合件的酸洗。使用一般不低于0.1% (质量分数)。先将计量的缓蚀剂按1 : (10~20)兑水(最好是50~60°C的温水),搅拌至完全溶解,然后再加余量水,搅匀,按计量与酸混合均匀后。
③Lan-815固体多用酸洗缓蚀剂主要成分为有机氮化合物,奶白色固体粉末;用于碳酸盐垢、氧化铁垢、硫酸钙垢、硅质垢、混合垢等。适用于碳钢、不锈钢、铜、铝等金属材质及其不同材质的组合件的酸洗。可与硝酸、盐酸、硫酸、氢氟酸、氨基磺酸、草酸、酒石酸、EDTA、羟基乙酸等十多种无机酸、有机酸及其混合酸等混合使用。
先将缓蚀剂用水化开,然后注入搅拌槽混合均匀,加入酸即可配制成缓蚀酸洗液。
④Lan-826我国1984年开发的一种多用酸洗缓蚀剂,曾获国家科技发明三等奖。目前,在工业清洗中仍得到广泛应用。在各种化学酸洗过程中都有良好的缓蚀效果,并有优良的抑制钢铁在酸洗过程中吸氢的能力,同时抑制酸洗过程中Fe³+对金属的腐蚀,使金属不产生孔蚀。适用于各种无机酸、有机酸,包括氧化性酸等。可配合各种化学清洗用的酸来清除碳酸钙型、氧化铁型、硫酸钙型各类污垢,适用于以碳钢、合金钢、不锈钢、铜铝等金属及其不同材料的连接结构的酸洗。
对环境无污染:对金属基体的腐蚀小、缓蚀效率高,酸洗过程中没有酸雾,使用安全,可配合各种化学清洗用酸清除各种类型的污垢。与无机酸配合使用一般在3% ~10%,常温或低于45℃;与有机酸配合使用一般在3%~20%,温度60~90°C
(5)铜缓蚀剂巯基苯并噻唑(MBT)、 巯基苯并咪唑在pH变化范围内很稳定,是对铜及铜合金最有效的缓蚀剂之一,对碳钢产品也有保护作用。可以抑制酸对各种铜的腐蚀,并能抑制对铜合金的腐蚀。适用于去除碳酸盐、铁锈、硅酸盐、硫酸盐等各种类型的污垢。
适用设备材质:黄铜、白铜、紫铜及其他铜合金的化学清洗。对碳钢、不锈钢等金属亦有良好的缓蚀效果。
适用酸的范围。盐酸、硝酸、硫酸、氢氟酸、氨基磺酸、草酸、酒石酸、EDTA:羟基乙酸等十多种无机酸、有机酸及其混合酸等。
使用方法:先将缓蚀剂用水化开,然后注入搅拌槽混合均匀,加入酸即可配制成酸洗液。
苯并三氨唑(BTA)、甲基苯并三氮唑(TTA)等可以作铜缓蚀剂。
苯并三氨唑(BTA)水溶液呈弱酸性,PH为5.5~6.5,对酸、碱都稳定,易落于甲醇、丙酮、乙醚等,难溶于水和石油溶利。用于铜、铝、锌、镍的缓蚀剂。主要用于铜、铝等制成的用水设备的防腐。作缓蚀剂时,一般投加(0.5~2.0)×10¯⁶,BTA在各种水质条件下都有缓蚀作用,在时H为5~10范围使用效果较好。
对冷却水系统可用水溶性苯并三氮唑(液BTA);该产品是苯并三氮唑的改进产品,有良好的缓蚀作用,能与水以任何比比例迅速互溶,适用于锅或铜-铁共存材质的水系统的防腐。
(6)软化水缓蚀剂有些水体中二价金属离子(Ca²+、 Mg²+、Zn²+)严重不足,难以在金属表面形成保护膜,所以需要使用亚硝酸盐缓蚀剂。
CQ-424软化水专用缓蚀剂主要由钼盐、磷酸酯及助剂等复合配制而成,可用于循环软化水系统的缓蚀剂。投加量为100x10¯⁶,能在金属表面形成致密的保护膜。
3.4.5 漂洗与钝化
化学清洗除垢后的基质表面处于活化状态,易被腐蚀,所以需要钝化,有效钝化的前提是基体具有洁净的表面,漂洗可以清除余酸,清洁基体,清除和防止表面三次上锈。
3.4.5.1 漂洗
二次上锈的机理与一次上锈的机理相同。
(1)柠檬酸(C₆H₈O₇)目前多数用柠檬酸作漂洗剂,,含量为0.1%~2%,用柠檬酸水溶液冲洗时,可以把二次锈转化为柠檬酸铁络合物而溶解。漂洗时应控制铁离子(Fe³+ )浓度≤10mol/L (560g/L),按此临界值计算,pH应控制不高于2,否则会生成氢氧化铁[Fe(OH)₃]沉淀。若 Fe³+控制得较低,则生成[Fe(OH)₃] 沉淀的临界pH可以适当放宽(但一般pH不超过4)。漂洗温度控制在75~90°C,适当加入一些缓蚀剂会减 小其漂洗阶段的腐蚀速率。
(2)氢氟酸(HF)成 HF是弱酸,可作为漂洗液,当其含量为0.005%、漂洗液的pH约为3.5时,对金属基体的腐蚀相对较小:由于HF对铁锈有 很好的溶解性、对Fe³+ 有很强的络合作用,所以用HF作漂洗液是一种有效的方法。
3.4.5.2 钝化
钝化是把金属由活泼状态转变成钝态的过程。经化学清洗和漂洗后的金属表面化学性质活泼,很容易返锈,因此需要进行漂洗、钝化处理,性别是在酸洗之后(碱洗后金属表面的化学活性相对较低),可用碱性亚硝防钠或磷酸三钠对金属进行钝化处理。
铁基体表面发生钝化是因为其表面形成了一层不溶性的氧化物膜, 层膜可以使铁被氧化、失去电子(溶解) 的阳极反应受阻,而使腐蚀速率大大降低。例如,在浓硝酸等氧化性清洗剂中处理铁垢时,基质表面形成250~300nm的Fe₂O₃钝化膜;而同样条件下处理的不锈钢表面形成90~100nm的钝化膜。这些超薄的钝化膜具有完整、连续的特点,因而能保护金属基体不再遭受腐蚀。而在NaNO₂、N₂H₄等还原性药剂中可以使其形成以Fe₃O₄为主的钝化膜。
(1)钝化方法和钝化机理
①氧化法。习惯用亚硝酸钠作为钝化剂(1.0%~2.0%),用氨水调节钝化液pH在9.0~10.0之间,金属表面可形成不溶性教密的氧化膜,阻止金属腐蚀的阳极过程进行。该钝化膜抗腐蚀能力强,被化学清洗界称为“王牌”钝化工艺。亚硝酸钝化的反应式如下。
2Fe+ NaNO₂ +2H₂O→NaOH+ NH₃ + Fe₂O₃
3Fe₂O₃+NaNO₂ =2Fe₃O₄+NaNO₃
优点:钝化温度低,时间短,钝化膜致密且牢固,表面状态及保护效果好,耐蚀性好。
缺点:工艺复杂,毒性大,费用高,属于此类型钝化工艺的还有双氧水钝化法等。
氧化法还有过氧化氢法。其优点是:无毒,工艺简单,钝化温度低,时间短,钝化膜致密且牢固,表面状态及保护效果好,耐蚀性好,兼有除铜作用。缺点是:需严格控温,防止过氧化氢分解。
②磷化法出可用磷酸三钠(1%~2%)或磷酸(0. 15%)与三聚磷酸钠(0.2%)混合液作为钝化剂,用氨水调节钝化液pH在9.5~10.0之间, 其钝化机理是磷酸盐分子能与金属阳极腐蚀下来的铁离子(Fe²+ )形成难溶的磷酸铁钠盐膜覆盖于金属表面上,阻滞了阳极过程的进行。磷化法钝化反应式如下。
3Fe+2H₂O+O₂→Fe₃O₄+2H₂↑
3Fe₃O₄+2Na₃PO₄+3H₂O→Fe₃(PO₄)₂·3Fe₂O₃ +6NaOH
优点:方法成熟,废液处理简单。
缺点:对温度有较高的要求,钝化时间也稍长,钝化膜的表面状态及保护效果不如亚硝酸钠法。
③还原法以联氨(300~ 500mg/L)为代表,用氨水调节钝化液pH在9.5~10.0之间,当金属阳极区遭受氧腐蚀产生Fe₂O₃时,联氨可将其还原成Fe₂O₃膜,阻滞阳极过程。其反应式如下。
6Fe₂O₃+N₂H₄→-4Fe₃O₄+N₂+2H₂O
其缺点是联氨具有一定的毒性。
近几年不断出现新型还原剂如丙酮肟、二已基羟胺等取代联氨,文献显示,采用新型还原剂进行钝化,抗锈蚀能力并不理想。
④吸附法有报道“十八烷基胺”等有机物可可以作钝化剂,其机理是
含有极性氨基化合物,在水中可形成一种带正电荷的阳离子,反应式如下。
RNH₂+H=RNH₃+
当这种阳离子与金属接触时,就被金属表面带负电荷的部位所吸附,形成单分子的吸附膜。由于金属表面吸附了阳离子后,其结果使带正电荷的离子(氢离子和溶解氧)难以接近,起到了屏蔽隔离作用,控制了阴极过程进行,金属腐蚀速率降低。另一种理论则认为,有机正烷胺分子中极性基(-NH₂)的中心原子含有未共享电子对,它可以与铁的d电子空轨道进行络合结合所引起的吸附,即能在金属表面生成一层致密的保护膜。
(2)钝化剂的影响因素
①钝化剂浓度的影响钝化剂的浓度要足量,若浓度不足时,在阳极生成的钝化膜就会不完整,钝化膜就会形成新的阴极(相对较大),而缺路处会变成新的阳极(相对较小),这样就形成了小阳极对大阴极,在阳极处形成较大的腐蚀电流,造成孔蚀
②温度对钝化效果的影响不同的钝化剂在其特定的温度范围内,可形成致密可靠的保护膜。因此,要根据所选择钝化剂的特点来选择最佳钝化温度。
③pH对钝化效果的影响德金属的钝化一般在碱性介质进行,但不是说碱性越强越好。当超过一定值以后,反而会加剧金属腐蚀,因为金属在强碱溶液中形成没有保护性能的亚铁酸盐和铁酸盐,钝化的pH范围应选择在9~12之间最好。
④铁离子对钝化效果的影响_当铁离子浓度较高时, 在碱性条件下容 易生成氢氧化物沉淀,附着在金属表面,一方 面沉淀物没有保护金属不受进一步腐蚀的能力:另一方面影响钝化过程中钝化膜的完整形成。为了保证钝化效果,总铁离子含量应小于500mg/L,以小于300mg/L为宜。
3.4.6助剂
为充分清洗,同时保护基体,还需加入各种助剂,如助洗剂、助溶剂等。
3.4.6.1助洗剂
(1)助洗剂的功能助洗剂可起到降低水中钙、镁离子的浓度,清洗液的pH,对污垢起分散作用,同时与表面活性剂产生协同效庄稳定 。
①去除Ca²+、Mg²+ 等金属离子。水中所含 Ca²+、Mg²+等金浓度较高时,会降低清洗剂的去污效果。因为清洗剂中的表面活性属离子数是一价负离子,如RCOO¯、RSO₃¯,而这些负离子往往能与Ca²+Mg²+生成沉淀而失去活性。
若在清洗剂中加入掩蔽剂(偏硅酸钠、Na₂CO₃、 磷酸钠、三聚酸钠等),可以大大降低其自由Ca²+、Mg³+的浓度,使表面活性剂发挥最佳的去污效果。
②稳定pH化学清洗时,保持洗液的pH相对稳定非常关键,助剂在水溶液中具有碱性缓冲能力,保持溶液的pH相对稳定,另外碱性助剂可以使油污中的脂肪酸皂化。pH对助剂的螯合能力也有很大影响。各种助剂在不同pH下对Ca²+的螯合值如表1-2所示。
另外,pH偏高时有利于使清洗后污垢胶体表面带负电荷,可防止污垢 的絮凝,使再沉积的倾向减小。一些 助剂对盐酸酸性的缓冲能力如表1-3所示。
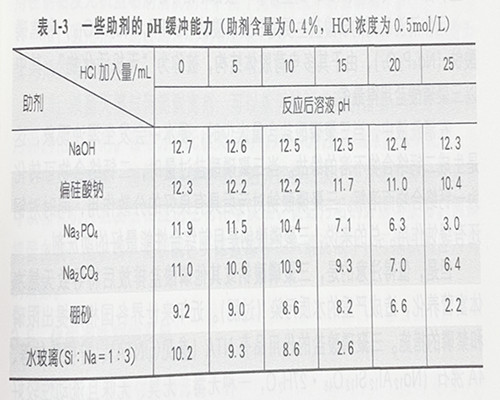
从表1-3可以看出,助剂含量为0.4%时,NaOH、偏硅酸钠对HCE有足够的抵御能力,Na₃PO₄、Na₂CO₃与HCI反应分别生成Na₂HPO₄、 NaHCO₃,构成了酸碱缓冲对Na₂HPO₄-Na₃PO₄、NaHCO₃-Na₂CO₃,在一定的范围内起到了稳定溶液pH的作用,而硼砂和水玻璃(Si:Na=1: 3)对低浓度HCI具有一定的缓冲能力,但HCI浓度偏高时,其缓冲作用相对较小,甚至失去缓冲作用。
③对污垢的分散作用助洗剂还具有分散污垢的作用,从而大大减了污垢在基质表面的再次沉积。
在常用助剂中, STPP (三聚磷酸钠) 对污垢的分散能力最好。STP 对极性污垢(如高岭22) 的分散能力明显优于其他助剂。另外,STPP习 氧化铁粉末也有很好的分散效果,但对于非极性固体污垢(如石墨) 的分散效果不明显。
④助剂与表面活性剂的协同效应若助剂与表面活性剂复配得当,可使表面活性剂的去污力明显增加,这种现象称为协同效应。
研究表明,STPP与表面活性剂的协同效应明显优于柠檬酸钠。因此, 它是更为有效的助剂。另外,STPP 对极性的油垢有明显的降低“油/水 "界面张力的功能,即具有胶溶性能,使油污更易分散于水中。
(2)几种清洗助剂清洗助剂可分为有机助剂和无机助剂。常用的助剂有以下几种。
①磷酸盐清洗助剂中常用的磷酸盐有正磷酸盐、二聚磷酸盐(焦磷酸盐)、三聚磷酸盐和六偏磷酸盐等,而且多以钠盐形式作为助洗剂。
正磷酸是磷酸中最重要的一种,它可以形成三种类型的盐,即磷酸盐 (正盐) M₃PO₄,如Na₃PO₄;磷酸氢盐M₂HPO₄,如Na₂HPO₄;磷酸二氢盐MH₂PO₄,如NaH₂PO₄。大多数磷酸二氢盐都易溶于水,而磷酸氢盐和正盐,除Na+、K+、NH₄的盐外,一般都不溶于水。
用作清洗助剂的磷酸盐主要是三聚磷酸钠(STPP,Na₅P₃O₁₀)和焦磷 酸钠(Na₄P₂O₇); 由于其多电荷胶体结构,被称为“无机活化物”, 其中以三聚磷酸盐用得最多。
在清洗液中,当三聚磷酸盐含量太少时,硬水中会发生浑浊现象,这是生成二钙络合物不溶的缘故。当三聚磷酸盐过量时,二钙络合物可转化为钙络合物而溶解。三聚磷酸钠对污垢具有良好的分散作用,同时对钢还有缓蚀作用。总的来说,三聚磷酸钠是目前综合性能最好的助洗剂。但是,值得注意的是,三聚磷酸钠或其他磷酸盐排放后将导致天然水体富营养化,造成严重的水质污染(过肥)。近年来世界各国相继提出限磷和禁磷的措施。三聚磷酸盐的代用品有NTA (参见⑤NTA)、柠檬酸钠等、 4A沸石(Na₁₂Al₁₂Si₁₂O₄₈·27H₂O,一种无毒、 无臭、无味且流动性较好的白色粉末,具有较强的钙离子交换能力,对环境无污染)。
②硅酸钠(Na₂SiO₃)硅酸钠的浓水溶液通常称为水玻璃,它是没有固定组成的碱性硅酸盐。清洗剂中的硅酸钠是一种重要的助洗剂,它与其他助洗剂配合使用可起到协同效果,而且它在清洗剂中可以维持溶液一定的碱性,分散、悬浮污垢微粒,抑制金属腐蚀等。
③碳酸钠(Na₂CO₃,纯碱) 碳酸钠在水溶液中呈碱性,能使脂肪污垢皂化,提高表面活性剂对油性污的清洗能力,且对泡沫的生成有促进作用,同时可以与Ca²+生成CaCO₃,沉淀,有效地降低溶波中Ca²+浓度,降低水的硬度。
④乙二胺四乙酸(EDTA)EDTA是一种很强的有机络合剂,可与水中的钙、镁离子发生络合反应,从而大大降低水的硬度。有EDTA存在时,清洗剂的去污作用虽然略有提高,但远不如添加复合磷酸盐。它主要用于无磷或少磷洗涤剂中。EDTA也可以作酸洗助剂。
⑤次氮基三乙酸(NTA)化学式为N(CH₂COOH)₃,白色结晶粉末,不溶于水,溶于碱性溶液,具有非常强的络合能力,对钙、镁离子的络合能力强于STPP,但在20世纪60年代末发现它会造成胎儿畸变,后来又发现浓度高的NTA会致癌。尽管实际使用的清洗剂中NTA含量不致发生这种危险,但人们对它的担心却始终存在。1984 年美国纽约颁布了禁用NTA的法令。
3.4.6.2其他助剂
(1) 金属离子络合剂 借助于和污垢中的金属离子发生络合反应,使污垢转变为易溶于清洗剂的试剂,也可以与水中的金属离子发生络合反应,降低水的硬度,提高活性成分的去污能力。例如EDTA等一些有机络合剂可与水中的钙、镁离子发生络合反应,从而大大降低水的硬度。络合剂常用在锈垢及无机盐垢的清洗剂中,用于掩蔽溶液中的金属离子。
(2)吸附剂通过对污垢的物理吸附或化学吸附而清除污垢的物质为清洗用的吸附剂。
(3)杀菌灭藻与污泥剥离剂可以杀灭基体表面的菌藻、剥离微生物污泥的化学药剂。它可分为无机类与有机类,无机类的通常是强氧化剂。
(4)酶制剂酶制剂是具有催化能力的蛋白质。在法垢的清洗中,它可以和有机污垢发生相应的的生物化学反应,促进污垢的分解与脱落。例如把在包属、脂房、淀粉醉、纤维素酶等加入清洗波中,可加快相应污看的清除。
详见清洗剂生产备制方法
低污染金属去污垢防锈清洗剂制备方法https://www.999gou.cn/article.php?id=4840
常温金属设备去锈蚀清洗剂制备方法https://www.999gou.cn/article.php?id=4841
金属设备污渍除锈清洗剂制备方法https://www.999gou.cn/article.php?id=4842
金属制品缓蚀防锈清洗剂制备方法https://www.999gou.cn/article.php?id=4843