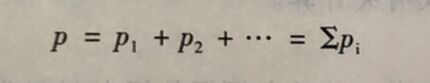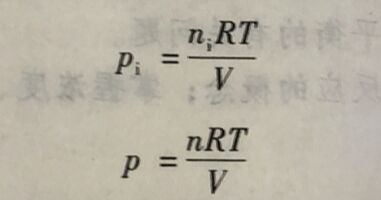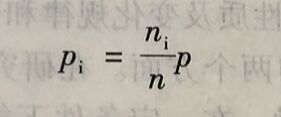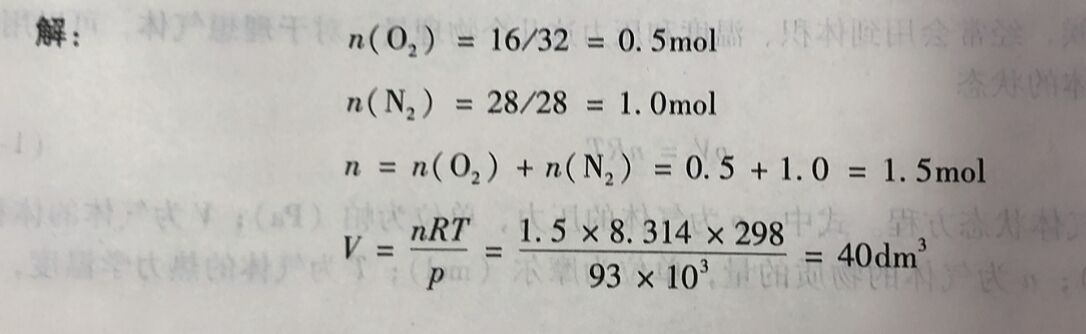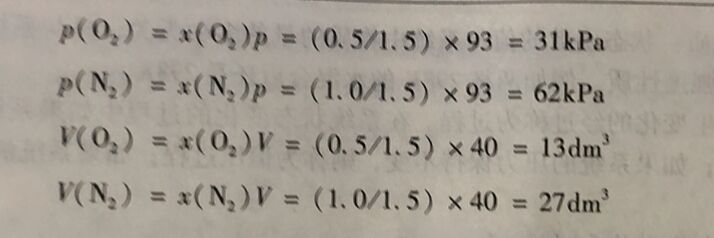气体
铜臭 / 2022-07-11
气体、液体和固体是物质最主要的三种聚集状态。气体是其中一种比较简 单的聚集状态。
1.1.1理想气体状态方程
假设有一种气体, 气体分子本身体积极小, 分子之间没有相互吸引力,这种气体称为理想气体。实际上,理想气体是不存在的。研究结果表明,在高温、低压条件下,气体分子间的距离大,分子本身的体积和分子间的作用力均可以忽略,这时的气体就可以近似看作是理想气体。
描述气体的时候,经常会用到体积、温度和压力这几个物理量。对于理想气体,可以用下面的公式来描述气体的状态
pV= nRT
该式即为理想气体状态方程。式中,p为气体的压力,单位为帕(Pa); V为气体的体积 单位为立方米(m³); n为气体的物质的量,单位为摩尔(mol); T为气体的热力学温度,单位为开(K): R为摩尔气体常数,其常用值为8.314/(mol·K)。
1.1.2气体分压定律
实际生产过程中,经常遇到的是气体混合物。例如,空气就是由氧气、复气、二氧化碳和稀有气体等多种气体组成的混合物。通常,把组成混合气体的每-种气体称为混合气体的组分气体。混合气体中各组分气体的含量可以用组分气体的分压来表示。
在混合气体中、某组分气体对周围环境施加的压力称为组分气体的分压力。它等于相同温度下,组分气体单独占有与混合气体相同体积时所具有的压力。混合气体的总压力等于各组分气体的分压力之和,这种关系称为道尔顿分压定律。
如果以p表示总压力,以p表示组分气体i的分压力,则有以下关系式存在
式中,Pi表示i组分气体的分压。
如果以ni和n分别表示组分气体和混合气体的物质的量,则
式中,V为混合气体的体积,两式相除即可以得到
式中,(ni/n)即为组分气体i的物质的量分数(摩尔分数)、可以用xi表示,则i组分气体的分压
Pi=xip
例1-1在容器中含有NH₃、 O₂和N₂的混合气体,其中含有0.24mol NH₃,0. 36mol O₂,1.40mol N₂计算总压力为101.3kPa时各组分气体的分压?
解:n=n(NH₃) +n(O₂) +n(N₂) =0.24 +0.36+1.4 = 200mol
p(NH₃) =x(NH₃)p= (0.24/2) x101.3 = 12. 2kPa
p(O₂) =x(O₂)p= (0.36/2) x101.3 = 18.2kPa
p(N₂) =x(N₂)p= (1.4/2) x101.3=70. 9kPa
例1-2 298K时,在一个密团容容中充人16g氧气和28g氧气,测得容器中气体的总压力为93kPa计算该容器的体积?两种气体的分压?两种气体的分体积?