一、影响反应速度的主要因素
化学反应速度的大小首先决定于反应物本身的性质,即不同的反应物有不同的反应速度。例如氟的化学性质比氦活泼,故氟和氢的化合反应,在很低的温度下也会在瞬间完成;而氦和氢的化合反应,即使在常温下也进行得极慢。其次,反应条件对化学反应速度也有很大影响。反应条件中最主要的是反应物的浓度、温度和催化剂。下面着重讨论这些条件对反应速度的影响:
1.浓度—质量作用定律。现以氢气和碘蒸气在一定体积的密闭容器中生成碘化氢气体为例,来讨论反应物H₂+I₂的浓度 [H₂][I₂]与反应速度v的关系。碘与氢的反应:
H₂+I₂=2HI
为行实验证明,在某一温度下,当H:和I,蒸气的浓度都是0.1克分子/升时,反应速度(以H₂或I₂蒸气浓度的减少表示)为0.001克分子/升.分;如果氢的浓度增加到原来的2倍,反应速度也增 加到原来的2倍,为0.001×2 =0.002克分子/升.分;如果氢的浓度增加到原来的4倍,碘蒸气的浓度增加到原来的2倍,反应 速度就增加到原来的8倍,为0.001×4×2 =0.008克分子/升·分。由此可见,反应速度与H₂和I₂蒸气的浓度乘积成正比,即v∝[H₂][I₂]。研究其它物质的反应速度,也得到同样的结果。
大量实验证明:在一定温度下,化学方程式中反应物的系数为1时,化学反应速度与各反应物的浓度乘积成正比;化学方程式中反应物的系数不为1时,化学反应速度与各反应物浓度的幂次(幂次数等于化学方程式中反应物的系数)乘积成正比:
A+B=C+D
v∝[A][B]
v=k[A][B]
若有m个A分子和n个B分子发生反应:
mA +nB= pC+qD
则反应速度为: V= k[A]m[B]n
上式为质量作用定律数学表达式的通式,其中反应物浓度的幂次数就是化学方程式中该反应物分子式前面的系数。
式中的k称反应速度常数。它的值等于各反应物浓度为1克分子/升时的反应速度的值,所以又称比速常数。
v=k[A]m[B]n [A]=[B]=1
v=k
k值与反应种类和温度有关,与反应物的浓度和压力无关。故同 一反应在一定温度下,k值才是一个定值。k值愈大,反应的速度愈快。
利用质量作用定律数学表达式,可以进行有关计算,如已知反应物在一定浓度下的反应速度时,即可求得反应速度常数k;或已知反应速度常数k,即可求出不同浓度时的反应速度。
使用质量作用定律计算时应注意,反应物的浓度只计算气体物质的浓度或溶液中反应物的浓度,而不计算固体物质的浓度。这是因为化学上规定纯固体物质的浓度(严格地说是活度)等于1。有固体物质参加的反应属多相反应,在下面还要讨论。
2.温度。温度是影响反应速度的一个重要因素。温度增高, 反应速度增大:温度降低,反应速度减小。 实验证明,温度每升 高10°C,反应速度一般增大到原来速度的2~4倍。这在日常生活中很容易看到。如铁器在高温时比在低温时容易氧化,煤在低温时并不燃烧(即不和氧气作用),温度愈高燃烧愈旺。
温度所以能使反应速度加快,是因反应速度常数随温度升高而增大。公式v=k[A]m[B]n中的[A]m、[B]n不变时,温度升高,k值增大,v也加快。
3. 催化剂。 催化剂是一种能改变反应速度,而它本身的组成,重量和化学性质在反应前后却保持不变的物质。催化剂对化学反应速度的影响十分显著,远远超过增加浓度和升高温度的影响。某些反应由于加入了催化剂,可使其反应速度增大到几百倍 到几千倍。例如过氧化氢(H₂O₂)的水溶液在常温下分解很慢,但只要加入微量的MnO₂粉末,就会很快分解为水和氧。
催化剂在现代化学工业中,占有极其重要的地位。例如在硫酸、合成氨、石油的裂化、高分子化合物的合成、橡胶和化学纤维等等的生产中,都离不开催化剂。
催化剂分正催化剂和负催化剂两种。正催化剂一般称为催化剂,能使反应速度加快,如工业上用合成法制氨时所用的催化剂(含有氧化铝和氧化钾的铁粒),负催化剂能使反应速度减慢,如在酸洗锅炉时加入的缓蚀剂若手、六次甲基四胺(乌洛托平),以及在变压器抽中加入的抗氧剂等。
催化剂具有选择性,即某反应有它独特的催化剂。例如五氧化二钒(V₂O₅)是制取硫酸时SO₂氧化成SO₃。的有效催化剂,但它对合成氨的反应却无效。因此,在选用催化剂时,必须根据具体反应经过许多次实验比较而后确定。
有些化学反应的某种生成物本身就可起催化作用,不需外加催化剂,这种作用称为自动催化作用。例如H₂C₂O₄在硫酸溶液中,滴入数滴KMnO₄溶液,最初儿乎不发生显著的反应,但不久反应就越来越快,能使继续滴入的高锰酸钾溶液立即褪色。反应如下:
5H₂C₂O₄+ 2KMnO₄+ 3H₂SO₄=K₂SO₄+ 2MnSO₄+ 10CO₂+8H₂O
这是由于产物中的锰离子( Mn²⁺),就是此反应的催化剂,从而使反应速度加快。
有些物质本身并不是催化剂,但当把它们加入催化剂中,却能增加催化剂的催化能力,这种物质称为助催化剂。例如合成氨 的催化剂金属铁中添加的K₂O和AI₂O₃,即为助催化剂。还有一些物质即使是很少量,当混入催化剂或者被催化剂表面所吸附时,会显著使催化剂降低甚至失去催化能力,这种物质称为催化毒物。这种使催化剂降低或失去催化作用的现象,称为催化剂的中毒。例如硫、磷和砷的化合物是铂催化剂的毒物,在反应气体中只要含有少量这类物质,就容易使铂催化剂失去活性。
二、活化分子和活化能
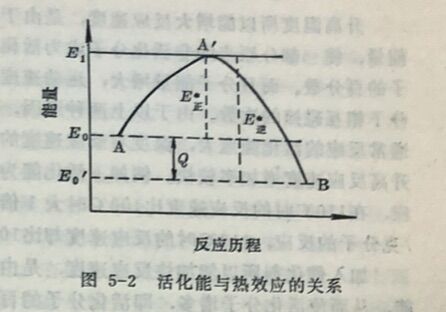
化学反应的先决条件是反应物分子之间要互相碰撞,如果反应物分子不接触,那就谈不上发生反应,但也并不是反应物分子之间每一次碰撞都能发生反应。以气体间的反应为例,气体分子以极大的速度在空间运动着,分子之间不断地互相碰撞,如果每次碰撞都发生反应,那么所有气体反应不但能在瞬间完成,而且反应速度也应相近。但事实上在同样条件下,不同气体的反应速度不同,有的快有的慢,甚至相差很大,这就说明了气体分子并 不是每一次碰撞时 都能发生反应,而是在千万次的碰撞中,只有少数的分子在碰撞时才能够发生反应。这种能发生反应的碰撞叫做有效碰撞,能够发生有效碰撞的分子称为活化分子。活化分子具有的能量,比一般分子的平均能量要高。某反应的活化分子具有的最低能量与分子的平均能量之差叫做活化能(单位为千卡/克分子)。如图5-2所示。图中E₀和E₀'分别为反应物A和生成物 B的平均能量,E₁为分 子处于活化状态A'时的最低能量。E₁-E₀= E*正即为正反应的活化能;而E₁-E₀'= E*逆即为逆反应的活化能。E₁-E₀=E*逆-E*正=Q为反应的热效应。活化能的大小与反应物及生成物的性质有关,故不同的反应有不同的活化能。某些反应的活化能列于表5-1中。
活化能是决定反应速度的重要因素。在一定温度下,反应的活化能愈小,超过此能量的活化分子就愈多,反应速度就愈快;反之活化能较大的反应,其活化分子数就较少,反应速度也就较慢。例如在相同温度下,合成NH₃反应的活化能比合成HCI的大,因此前者的反应速度就较后者慢。
表5-1 某些反应的活化能
| 反应 |
活化能(千卡/克分子) |
N₂+3H₂=2NH₃
|
80.0 |
H₂+CI₂=2HCI
|
50.0 |
2Hl=H₂+I₂
|
44.0 |
Zn+2HCl=ZnCl₂+H₂
|
4.2 |
运用活化分子与活化能的概念,可以解释浓度、温度和催化剂对反应速度的影响。
增加浓度 所以能增加反应速度,是由于在一定温度时,某反应物分子中活化分子的百分数是一定的,当反应物浓度增大时,活化分子百分数虽不变,但单位体积内分子总数增多,活化分子总数也相应增多,单位时间内的有效碰撞次数也相应增多,因此,反应速度就变快。
升高温度所以能增大反应速度,是由于温度升高增大了分子能量,使一部分原来的非活化分子成为活化分子,增大了活化分子的百分数。而且分子能量增大,运动速度也加快,从而增加了分子相互碰撞的次数。由于以上两种原因,有效碰撞相应增加。通常反应的活化能愈大,温度对反应速度的影响也愈大,即温度升高反应速度增加率较快。例如,活化能为20千卡/克分子的反应,在110°C时的反应速度比100°C时大1倍;而活化能为40千卡/克分子的反应,110°C时的反应速度却比100°C时约大了3倍。
加入催化剂所以能加快反应速度,是由于降低了反应的活化能,从而使活化分子增多,即活化分子的百分数增大,使反应速度大为加快。例如合成氨的反应,在未加催化剂时反应的活化能 为80千卡/克分子,加入催化剂(或称触媒) Fe后活化能降到14~16千卡/克分子,分子有效碰撞机会大大增加,反应速度也就大大加快。
关于催化剂降低活化能的理论,尚不够成熟。
三、不均匀体系的反应速度
为了便于研究,根据需要常常规定一定范围的物质作为研究对象,这些物质便组成了体系。例如在钟罩中有一杯水,如果只研究杯中的水,那么可以只把水划为体系;如果是研究水和它周围的水蒸气,就可以把水和周围的水蒸气划为体系。在体系中,性质相同且完全均匀的部分称为相。所谓完全均匀是指各种物质之间没有界面,是以分子相互混合的。如混合气体、溶液都只有一个相,所组成的体系是单相体系或均相体系。因为它们任何部分的组成都是相同的,而且组成它们的各物质是以分子互相混合的。固体混合物却不是这样,即使它们是以极细的粉末混合时,也不是单相体系。因为每一颗粉末虽然很细小,但是仍包含了亿万个分子,因此不同物质的粉末之间都存在着界面;并且各物质的粉末性质也各不同。所以在固体混合物中,有几种物质就有几个相,所组成的体系是多相体系或不均匀体系。例如NaOI和KCl的固体混合物就有两个相,而NaCl和KCI的混合溶液则只有一个相。
由此可知, 一个相不一定是一种物质组成的,例如蔗糖水是一个相,这个相由糖和水组成;气体混合物(如空气)也只有一个相,它是由几种气体混合物组成的。不同的相不一定是由不同物质组成的,例如在一定的条件下,水蒸气水和冰共存时可组成一个三相体系,这三个相就是由同一种物质组成的。
如参加反应的各物质只有一个相,此化学反应就叫均相反应或单相反应。气体反应和溶液中各溶质之间的反应,因都只有一个相,所以是均相反应。有固体参加的反应是多相反应,即有两 个或两个以上的相。例如碳 与氧气化合成二氧化碳的反应, 碳是一个相,O₂和CO₂都是气体,是一个相,共有两个相,所以是多相反应。
影响不均匀体系反应速度的主要因素为接触面和扩散作用。在均匀体系中,所有分子只要运动都可以互相碰撞。但在不均匀体系中,只有在相与相界面上的分子互相碰撞,才有可能发生反应。因此对不均匀体系来说,影响反应速度的因素还与相和相之间接触面积的大小有关,接触面大,反应速度就快。例如电厂锅炉中呈悬浮状态的煤粉,比同重量的煤块要燃烧得旺。
决定不均匀体系反应速度的另一因素是扩散作用,即与生成物离开固体表面的速度和反应物到达固体表面的速度有关。扩散作用愈快,反应速度也愈大。在实验室和生产中,常用搅拌、摇动来增加扩散速度,以加快反应。