处于上述动态平衡的溶液,只要条件(如温度)不改变,物质就不会再溶解,溶液中已溶的溶质量也不会改变。我们把在一定条件下,溶解和结晶达到动态平衡时的溶液,即和过量固体溶质保持平衡状态的溶液,叫饱和溶液。在饱和溶液中,溶质的量最大。在实验室配制饱和溶液时,常常把溶质加到不再继续溶解,并且在溶液中保持有过量的固体溶质为止。溶液中溶质的量如果 低于最大值,固体溶质就会继续溶解。通常,把在一定 条件下还能继縷溶解该种溶质的溶液,叫做未饱和溶液。
2.溶解度。各种物质在水中的溶解能力是不同的,通常用溶解度表示物质溶解能力的大小。在一定条件下,某物质能溶解于一定量水中的最大量,叫做该物质的溶解度。实际上,溶解度就是饱和溶液的浓度。物质的溶解度一般以在一定温度下,该物质于100克水里达列饱和时所溶解的克数来表示,也可以用克分子/升和克当量/升等表示。
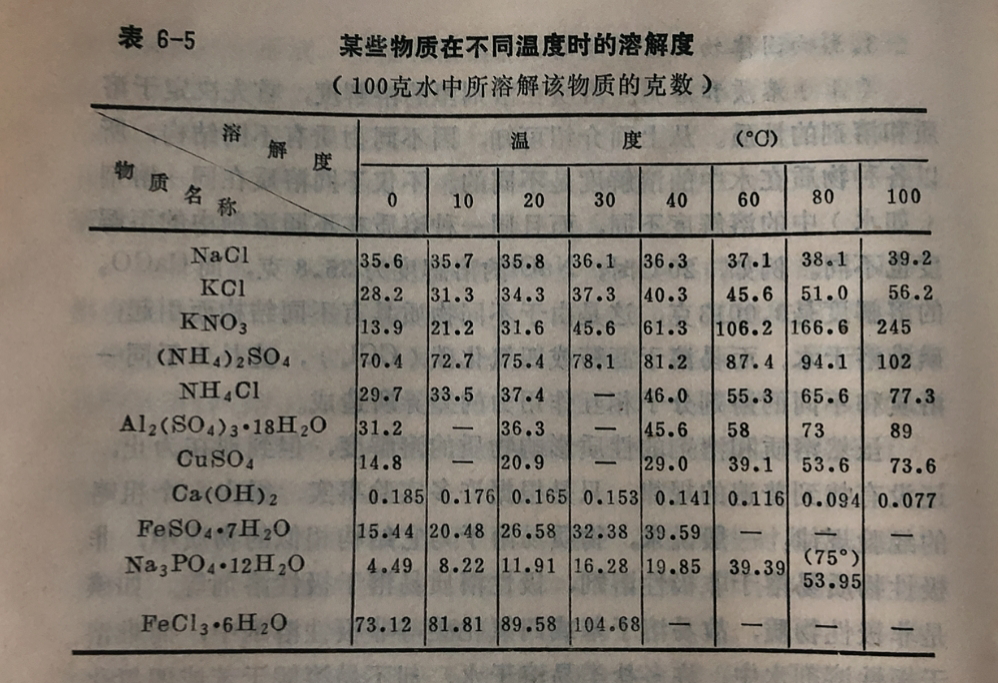
例如20°C时,在100克水里NaCl溶解到饱和程度时是35.8克,即NaC1在20°C时溶解度是35.8克。20°C时,Na₂CO₃的溶解度是21.5克,Ca(OH)₂的溶解度在20°C时是0.165克。显然,各种不同物质在水中的溶解度是不同的,因此溶解度是物质的一种属性。根据常温下溶解度的大小,一般可将物质分为以下三类:
可溶物质一一溶解度在1克/100克水以上者,如氯化钠 ( NaCI)、高锰酸钾( KMnO₄)和重碳酸钠( NaHCO₃)等。
微溶物质——溶解度在1~0.1克/100克水者,如硫酸钙 (CaSO₄)等。
难溶或不溶物质——溶解度在0.1克/100克水以下者,如碳 酸钙( CaCO₃)和氢氧化镁{Mg(OH)₂}等。
必须注意的是,溶液的“饱和”与“未饱和",和溶液的“浓”与“稀"是不同的两个概念,不可混淆。例如,20°C时在 100克水中能溶解(NH₄)₂SO₄75.4克,而CaCO₃则只能溶0.0013液。前者可以认为是浓溶液,后者是稀溶液,但两者都是饱和溶。
绝对不溶的物质是没有的,只是溶解度很小而已。各种物质的溶解度也只有在一定条件下才有确定的数值,当条件改变时,物质的溶解度也就随着改变了。
3.影响固体物质溶解度的因素:
(1)溶质和溶剂。溶质在溶剂里的溶解度,首先决定于溶质和溶剂的性质。从上面介绍可知,因不同物质有不同结构,所以各种物质在水中的溶解度是不同的。不仅不同溶质在同-榕剂(如水)中的溶解度不同,而且同一种溶质在不同溶剂中的溶解度也不同。例如,20°C时,NaCI的溶解度为35.8克,而CaCO₃的溶解度是0.0013克,这是由于不同物质具有不同结构而引起;碘难溶于水,而易溶于酒精或四氯化碳(CCl₄),这是由于同一溶质和不同的溶剂分子相互作用力的差异所造成。
虽然溶质和溶剂的性质影响物质的溶解度,但到现在为止,还没有找到普遍的规律,只是根据许多实验事实,得出一个粗略的经验规律:一般说来,物质易溶于与它结构相似的物质中,非极性物质易溶于非极性溶剂,极性溶质易溶于极性溶剂等。如碘是非极性物质,故易溶于苯或四氯化碳等非极性溶剂中,而难溶于极性溶剂水中;许多盐类易溶于水,却不易溶解于苯或四氯化碳等非极性溶剂中。
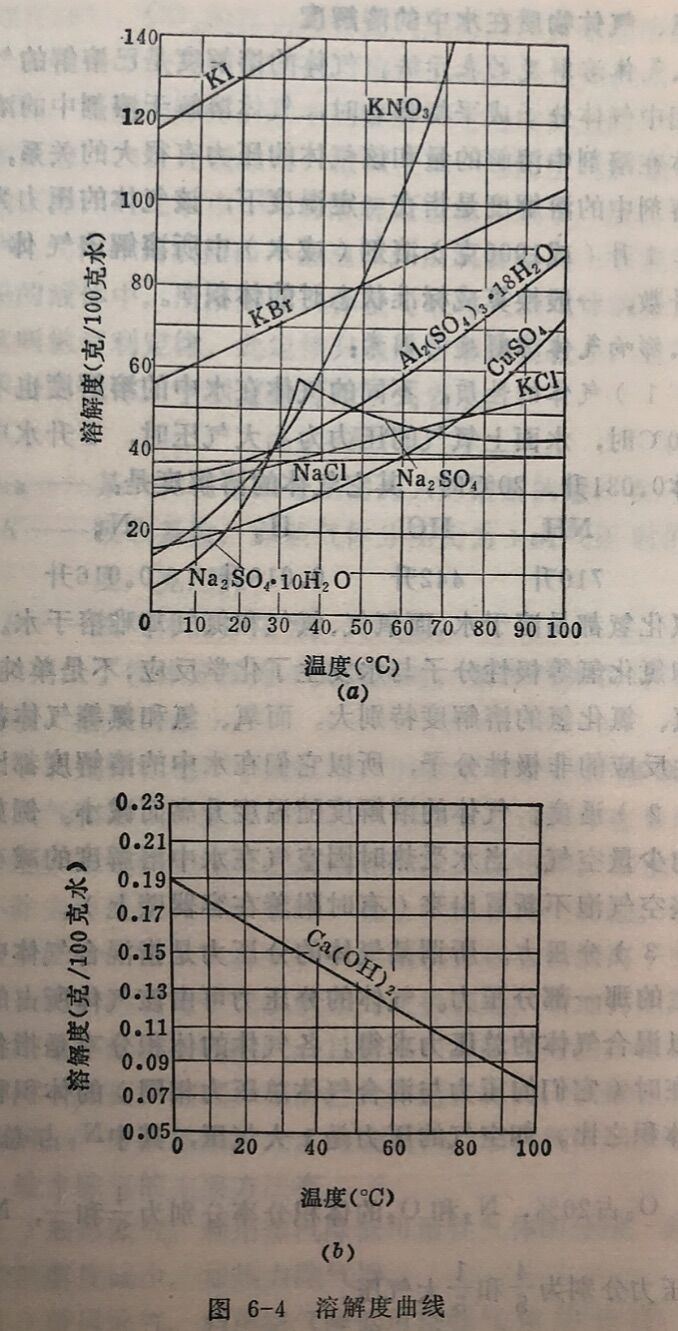
(2)温度。大多数固体物质的溶解度是随温度的升高而增 大的,如KNO₃、 CuSO₄等;少数固体物质的溶解度受温度的影响不大,如NaCl;也有少数固体物质的溶解度随温度的升高反 而减小,如Ca(OH)₂。此外,还有个别物质的溶解度比较特别,温度开始升高时,溶解度增大,到某温度时溶解度达最大值,温度继续升高时溶解度反而降低,这主要是由于物质的组成发生了变化,例如:
溶液中的硫酸钠,在32.4°C以下时,是Na₂SO₄·10H₂O,其溶 解度随温度升高而增大;在32.4°C以 上则是Na₂SO₄,其溶解度随温度升高反而下降。温度对各物质溶解度的影响各不相同,表6-5列出了某些物质在不同温度时的溶解度。
溶解度和温度的关系,用溶解度曲线表示时,较为直观明确,如图6-4所示。从图6-4中可以看出,不同物质的溶解度随温度改变的情况:各不相同,温度升高时,溶解度有的增加(如KCl), 有的减少(如Na₂SO₄),有的增加很快(如KNO₃),有的增 加很慢(如NaCl)。
压力对固体物质溶解度的影响很小,一般可不考虑。
二、液体物质在水中的溶解度
液体在水中的溶解度,也是大小不一的,有的可以按任何比例相互溶解,如酒精和水,有的实际上互不相溶,如水和汞;有的只能在一定限度内相互溶解,如四氯化碳和水。
两种液体能否相互溶解,通常决定于它们的分子结构是否相似,结构愈相似,互相溶解的程度愈大,反之,只能在一定限度 内相互溶解,或实际上互不相溶。如酒精( C₂H₅OH)的结构 中,有和水分子( HOH)结构相似的氢氧基( OH⁻),又有和 汽油(碳氢化合物的混合物)的结构相似的碳氢基( C₂H₅⁻),所以酒精既能溶于水又能溶于汽油,但是水和汽油的结构毫无共同之处,因此就互不相溶。