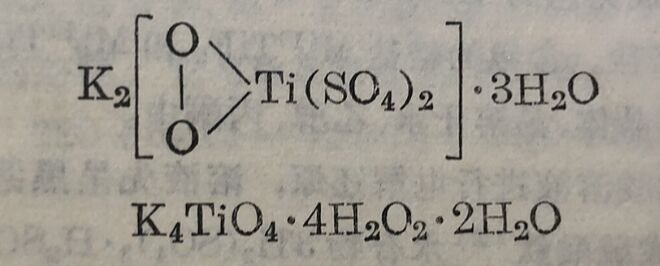鈦的化合物
铜臭 / 2022-08-06
鈦主要生成四价化合物,有鈦盐、鈦氧基盐和鈦酸盐。較不稳定的是三价鈦盐,二价鈦盐更不稳定。
1.四价鈦化合物
鈦在30°C以上与氯作用,生成四氯化鈦TiOL.純四氯化鈦是无色液体,凝固点-23°C, 沸点136.5°C,比重1.76(0°C时)。具有刺激性的嗅味。它的蒸气在潮湿空气中水解而冒濃烟,反应如下:
TiCl₄+2H₂O=TiO₂+4HCl
式中TiO₂代表TiO₄·xH₂O。若用酸阻止水解,可生成中間产物氯化氧鈦TiOCl₂,或称鈦酰氯。
四氯化鈦和氯离子生成格离子[TiCl₆]⁻⁻。會制得六氯鈦酸銨(NH₄)₂[TiCl₆],此盐系黄色晶体。但是自由酸仅能存在于水溶液中。
鈦在150°已能与氟作用,生成四氟化鈦TiF₄,它是疏松的白色粉末。最便利的制法是由TiCI₄和HF轉化而得。它生成絡合物的傾向比相应的氯化物为大。M₂⁽ᴵ⁾[TiF₆]型六氟鈦盐酸,不但已知有如式所表示的碱金屬盐,还有碱土金属盐和重金屬盐。鉀、銣、銫盐由于有特征的晶形,可用来檢定鈦。
黄色的四溴化鈦TiBr₄和紅棕色的四碘化鈦TiI₄可用类似的方法制备,它們都呈晶形。
将鈦酸(TiO₂·xH₂O)或二氧化鈦用漫硫酸加热轉化,生成硫酸氧鈦TiOSO₄,或称硫酸鈦酰,它为白色粉末,能溶于冷水中;热水会使它分解。
TiOSO₄+H₂O=TiO₂+H₂SO₄
自由状态的硫酸鈦正盐Ti(SO₄)₂尚未能确定其存在。另一方面,已知有M₂⁽ᴵ⁾[Ti(SO₄)₃] 型三硫酸基鈦酸盐,例如銨盐(NH₄)₂[Ti(SO₄)₃]·2H₂O。
二氧化鈦TiO₂在自然界中以金紅石的形式存在,为紅或黄紅色 晶体,密度4.2-4.3,熔点1800°C。金红石代表一种典型的晶型,(見图22-2)在其中Ti的配位数为6, O为3。
纯的二氧化鈦呈白色,是一种宝貴的白色顏料,叫做鈦白,它条有鉛白的掩盖性能和鋅白的持久性能。二氧化鈦加热时变黄色,冷下时再呈白色。即使是无定形的二氧化鈦,也不溶解于稀酸中,而只慢慢地溶解于热硫酸中,較快地溶解于熔融的碱金屬酸式盐中。生成的硫酸鈦和硫酸氧鈦,加水煮,即分解,虽然溶液是稀酸性的。这样得出的是β型鈦酸。另一方面,用碱金屬或銨的氫氧化物或碳酸盐在治时分解新制的酸性硫酸鈦溶液,得出的是x型鈦酸。这两个构型間性质的差异正象β型錫酸和普通的α型錫酸間的区别-一样。β型鈦酸的反应活性比普通的α型鈦酸要小得多。除热硫酸外,它几乎不溶于酸中。
用强碱液溶解α型鈦酸,蒸发,得碱金屬的倡鈦酸盐M₂⁽ᴵ⁾TiO₃水合物。无水盐可由二氧化鈦和碱金屬的碳酸盐熔融而制得;相应地可制取其他金属的鈦酸盐。在生成时,除偏鈦酸盐外,尚有部 分的正鈦酸盐M₄⁽ᴵ⁾TiO₄。BaTiO₃用于超声波发生装置中。
在自然界中广泛存在的鈦铁矿是偏鈦酸镌FeTiO₃。可注意的是,它和Fe₂O₃屬同晶形。因此, 鈦铁矿共存赤铁(Fe₂O₃)年共中TiO₂含量最高,竟达7%。
在鈦盐的中性或酸性溶液中加过氧化氢,溶波即皇梁检紅色。这灵敏的颜色反应可用来鉴定鈦。当溶液足够濃时,可用氨液将棕黃色的过氧鈦酸H₄TiO₅沉淀下来。沉淀系凝胶,具有不定的水含量。用丙酮在0°时使它干燥,得H₄TiO₅。它能在中性KI溶液中析出I,₂而H₂O₂或其加合物就不能,证明它是其正的过氧酸。对鉀盐来說,知道有真过氧酸和过氧化氢加合物二种。
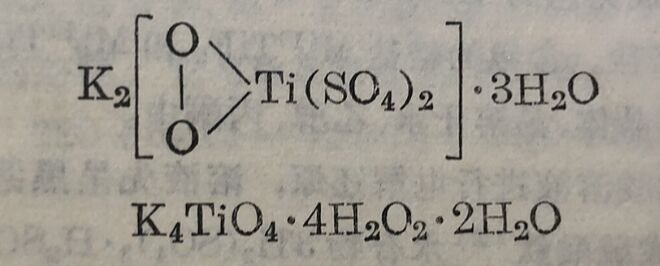
将四氯化鈦和硫化氫的混合气体通过灼热的瓷管,得二硫化鈦TiS₂。
TiCI₄+2H₂S=TiS₂+4HCl
二硫化鈦是黄銅色金屬光澤鳞状晶体。它在室溫时稳定,和水同煮也不分解,并且对稀硫酸、盐酸和氨都稳定。但是,硝酸和 热濃硫酸使它分解而析出硫。此外, 尚知有三硫化鈦TiS₃存在。
碳化鈦TiC可用灼热絲分解法(图22-1)制得。
TiCl₄+CO+3H₂=TiC+H₂O+4HCl
工业上制碳化鈦是由粉末状Ti或TiO₂和碳黑在2000°于H₂气氛中制得。所得粉末可以燒秸。碳化鈦在外观和化学作用上很象鈦,但耐酸性較鈦更强。碳化鈦晶格系食盐型。由于它具有很高的硬度和很高的熔点(3450°),因此它常用来制造硬合金(熔鑲在鈷或鎳中)和特殊耐热合金。
2.三价鈦化合物
用鋅及酸还原四价鈦化合物溶液,或用电解还原法,容易获得三价鈦化合物。三价鈦离子星紫色,具有强烈的还原性,比二价錫的还原性还要强得多。将四氯化鈦和多量氢的混合气体导过灼热管即可制取无水三氯化鈦TiCl₃,它为紫色粉末。三氯化鈦若在700°于氫气流中加热,就变为TiC₂和TiCl₄。用鋅处理四价鈦盐的盐酸溶液,或将鈦溶于盐酸中,得三氯化鈦的水溶液,可以结出六水合三氯化鈦TiCl₃·6H₂O的紫色晶体。如果在濃的溶液上面,加一层无水乙醚,并导入氯化氫至胞和,可由称色的乙醚溶液中得綠色的六水合物。这两个异构体,正象六水合三氯化路的情况样。无水TiCl₃和液态NH₃作用,生成无色的TiCl₃·6NH₃。綠色的三氯化鈦水合物能生成M₂⁽ᴵ⁾TiCl₅·H₂O型的格盐。含氟的格盐M₂⁽ᴵ⁾TiF₅和M₃⁽ᴵ⁾TiF₆更容易生成。TiBr₃·6H₂O是紅紫色晶体,易溶于水、乙醇、丙酮中。
将硫酸鈦⁽ᴵᵛ⁾的硫酸溶液进行电解还原,溶液先呈黑紫色,最后变为純紫色。由溶液可得酸式硫酸鈦⁽ᴵᴵᴵ⁾水合物3Ti₂(SO₄)₃·H₂SO₄·25H₂O,它为紫色称光晶形粉末。将此晶体和渡硫酸起加热, 冒烟完毕, 得无水硫酸鈦⁽ᴵᴵᴵ⁾正盐Ti₂(SO₄)₃,此盐为綠色晶形粉末,不溶于水、乙醇、浪硫酸;但溶于稀碗酸、盐酸中,溶液呈紫色。硫酸鈦⁽ᴵᴵᴵ⁾能生成M⁽ᴵ⁾Ti₃(SO₄)₅型水合物,如(NH₄)Ti₃(SO₄)₅·9H₂O和RbTi₃(SO₄)·12H₂O都系淺蓝色晶体,难溶于水。 关于硫酸鈦⁽ᴵᴵᴵ⁾的矾,仅知有红色的銣矾RbTi(SO₄)₂·12H₂O和淺紅紫色的 銫矾CsTi(SO₄)₂·12H₂O。
将二氧化钛在1000°于氢及四氯化鈦气流中加热,得晶形的三氧化二钛,熔点約1900°。它和刚石Al₂O₃同晶型。
若在高温时在氨气中还原致化合物,很易得到氮化鈦TIN,但通常不純。钝氮化鈦可由四氯化鈦或共氨合物在氨气流中强热而制得,純氮化鈦为青铜 色粉末,反应如下:
6TiCl₄+32NH₃=6TiN+N₂+24NH₄Cl
很純的氮化鈦可由灼热絲分解法(图22-1)获得。氮化鈦很稳定,在270°通氢时无变化。但是它和热的强碱液可起作用:
2TIN+4KOH+2H₂O=2K₂TiO₃+2NH₃+H₂
它也被过热的水蒸汽所分解。
2TIN+4H₂O=2TiO₂+2NH₃+H₂
氮化鈦的晶格屬食盐型,和ZrN、VN、NbN、SeN采同晶形。
3.二价鈦化合物
四价或三价鈦化合物受到强烈的还原时,得二价鈦化合物。例如以鈉汞齐还原四氯化鈦,所得二氯化鈦TiCl₂为黑色粉末。純的二氯化鈦可由TiCl₃的热分解或将TiCI₄和Ti屑一起加热而制得。二氯化鈦緩慢地分解水,并析出氩。它和液态氨能生成TiCl₂·4NH₃,它为有光澤的灰色粉末,它和TiCl₂一样,遇水析出氩。若将TiO溶于冷的稀盐酸中,得二氯化鈦的水溶液,其中含有三氯化鈦。在室温时,Ti⁺⁺相当迅速地被氧化为Ti³⁺;但在低温时,氧化緩慢;故溫度越低,二价状态的溶液就愈能保持。
加热Ti和TiO₂混合物,得一氧化鈦,熔点1750°。它和食盐同晶形,但在晶体中有部分的空隙。它与稀盐酸作用,析出氫:
TiO+6HCl→2TiCl₃+2H₂O+H₂
.jpg)