




![硫酸铈标准溶液浓度 c[Ce(SO4)2] = 0.1500 mol/L价格](images/202207/thumb_img/1632_thumb_G_1656925752112.jpg)
物质的焓H的绝对值无法确定,但是在实际的应用当中,更关心的是化学反应的热效应或者焓变△H。化学反应热效应的数值随反应的具体条件的变化而会有所改变,为了讨论的方便,有必要对物质所处的状态做出明确的规定。化学热力学上规定了物质的标准状态(简称标准态)。
标准状态是标准压力下物质的聚集状态。化学热力学中规定压力为100kPa的条件为标准压力,用pθ表示,右上角标θ表示标准状态。对于各种聚集状态具体的规定如下:
(1)气体的标准状态:分压为标准压力100kPa时的气体(在气态混合物中,指各气态物质的分压均为100kPa);
(2)溶液的标准状态:标准压力100kPa下,浓度为标准浓度cθ=1mol/dm3的溶液;
(3)固体或纯液体的标准状态:标准压力100kPa下的纯固体或纯液体。
.jpg)
要注意的是标准状态没有特别规定温度,如果没有特殊指明,温度度通常指的是298.15K。为了表示某一反应的焓变,采用了相对值的办法,也就是利用单质或者化合物的相对焓值运算得到反应的焓变。
在一定温度、标准状态下,由元素最稳定单质生成1mol纯物质时,反应的焓变就称为该物质的标准摩尔生成焓,用符号△Hθf表示,单位为kJ/mol,并选定温度为298.15K。标准摩尔生成焓的值越负,说明该物质对热越稳定。同时规定,元素最稳定单质的标准摩尔生成焓为零。每种元素仅有一种最稳定单质,例如氢是H2(g),氧是O2(g),氮是N2(g),碳是C(石墨),硫是S(正交),磷是P(白磷)。对于水合离子来说,规定水合氢离子在298.15K时的标准摩尔生成焓为零,其他水合离子的标准摩尔生成焓可以由此获得。
标准状态下反应的摩尔焓变即为标准摩尔焓变,用符号△Hθ表示。对任意化学反应,
aA+bB=dD +eE
根据盖斯定律有
△Hθ=△H2-△H1
△H1=a△Hθf(A)+b△Hθf(B)
△H2=d△Hθf(D)+e△Hθf(E)
△Hθ={d△Hθf(D)+e△Hθf(E)}-{a△Hθf(A)+b△Hθf(B)}
由此,各物质标准摩尔生成焓△Hθf与反应标准摩尔焓变△Hθ的关系如下
△Hθ=∑vi△Hθf(生成物)-∑vi△Hθf(反应物) (1-14)
式中,vi为反应式中物质i的计量系数。
应用式(1-14)计算反应的标准摩尔焓变时要注意:
(1)计算时是系统的终态减去始态;
(2)要考虑所有的各种物质的聚集状态,同一物质的不同聚集状态的标准摩尔生成焓不同;
(3)计量系数a,b,d,e不能遗漏;
(4)注意△Hθ的正负号,不可忽略,它有物理意义。
化学反应的标准摩尔焓变△Hθ随温度的变化不大,在本书中,近似计算日时可认为△Hθ与温度无关。
例1-10 光合作用的方程式如下:
6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) △Hθ=2802KJ/mol
计算C6H12O6的标准摩尔生成焓?每合成100g葡萄糖需要吸收多少能量?
解:查表得, △Hθf(CO2 )=-393 5kJ/mol
△Hθf(H20)=-285.8kJ/mol
△Hθf(C6H12O6)=△Hθ+6△Hθf(CO2)+6△Hθf(H2O)
=2802+6×(-393.5)+6×(-285.8)
=-1274kJ/mol
M(C6H12O6)=180.1g/mol
Q=(m/M)x△Hθ=(100/180.1)×2802=1556kJI/mol
在标准状态下,298.15K时,1mol物质完全燃烧日时反应的焓变,叫做这个物质的标准摩尔燃烧焓。以符号△Hθc表示,单位为kJ/mol。有时也把它称为燃烧焓或燃烧热。各种燃烧产物的燃烧焓均为零。热力学上规定,碳的燃烧产物为二氧化碳,氢的燃烧产物是水,氮的燃烧产物是氮气,硫的燃烧产物是二氧化硫。对任意化学反应,aA+bB=dD+eE
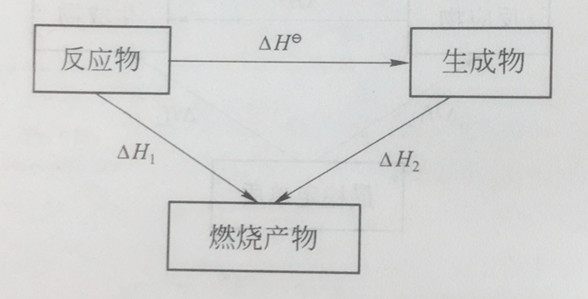
根据盖斯定律有
△Hθ=△H1-△H2
△H1=a△Hθc(A)+b△Hθc(B)
△H2=d△Hθc(D)+e△Hθc(E)
△Hθ={a△Hθc(A)+b△Hθc(B)}-{d△Hθc(D)+e△Hθc(E)}
各物质标准摩尔燃烧焓△Hθc与反应标准摩尔焓变△Hθ的关系如下
△Hθ=∑vi△Hθc(反应物)-∑vi△Hθc(生成物) (1-15)
