




多元弱酸的解离是分级进行的,每一级都对应一个解离平衡,都有一个解离常数。以氢硫酸H2S为例,其解离过程按以下两级进行
H2S(aq) ⇌ H+(aq)+HS-(aq) Ka1θ=1.32×10-7
HS-(aq) ⇌ H+(aq)+S2-(aq) Ka2θ=7.08×10-15
H2S二级解离的解离常数比一级解离常数要小得多,Ka2θ<Ka1θ。
计算溶液中H+浓度时,由于多元弱酸大多Ka1θ>>Ka2θ,一般可忽略二级解离平衡,与计算一元弱酸酸H+浓度的方法相同。
例2-10 计算在0.10mol/dm3H2S溶液中的H+、S2-浓度及pH值。
解:按一级解离计算溶液的H+浓度。
二级解离平衡 HS-(aq) ⇌ H+(aq) + S2-(aq)
平衡时/mol·dm-3 1.15×10-4-y 1.15×10-4+y y
=1.15×10-4 =1.15×10-4
由二级解离平衡可知,c(H+)=c(HS-),于是c(S2-)=Ka2θ=7.08×10-15mol/dm3。
从以上计算可知,对于二元弱酸溶液,其负二价酸根离子的浓度在数值上等于二级解离常数。该结论仅适用于纯的二元弱酸溶液。
例2-11 计算下列盐溶液的的pH值:
(1)0.10mol/dm3NaCN溶液;
(2)0.01mol/dm3Na2S溶液。
NH3·H2O的Kbθ=1.8×10-5,HCN的Kaθ=6.2×10-10,H2S的Ka1θ=1.32×10-7,Ka2θ=7.10×10-15。
解:(1)NaCN属于强碱弱酸盐
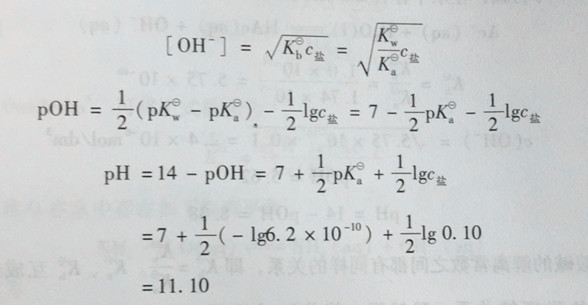
若按水解平衡式计算 CN- + H2O ⇌ HCN + OH-
平衡时浓度/mol·dm-3 0.10-x x x
x2/(0.10-x)=Kbθ=Kwθ/Kaθ=(1.0×10-14)/(6.2×10-10)=1.6×10-5
解得 x=1.26×10-3(mol/dm3)
pH=14-pOH=14-(-lg1.26×10-3)=11.10
(2)Na2S属于强碱弱酸盐,但由于该弱酸很弱,所以Na2S的水解度很大,其水溶液的pH值计算不能作近似处理,只能按水解平衡进行计算。
当忽略第二步水解时 S2- + H2O ⇌ HS- + OH-
平衡时浓度/mol·dm-3 0.010-x x x
x2/(0.010-x)=Kb1θ=Kwθ/Ka2θ=(1.0×10-14)/(7.10×10-15)=1.41
解得 x=0.00993(mol/dm3) pOH=2.003≈2.0
所以 pH=12
