- 离子反应方程式的书写
- 离子反应方程式的书写,如前所述,电解质(主要是碱、酸、盐)在溶液里所起的反应,主要是它们离子间的反应,为了更加符合于真实情况况,在表示这种反应的化学方程式里,应该用离子符号来代替溶液里的电解质的分子式(当然,反应里的非电解质,玻主要以分子状态存在的、电离度很小的弱电解质,仍应以分子式来表示),象这样的化学方程式,称做离子方程式
- 常见化学元素的化合价

- 常见化学元素的化合:什么叫做元素的化合价,在前面学习氧和氢时,我们已经接触到了不少具体的化合物,根据定组成定律,这些化合物都有固定不变的组成,它们的分子都是一定种类和一定数目的原子组成的,能够用一定的分子式来表示它们
- 氮族元素知识点是什么

- 氮族元素知识点是什么,氮族元素包括氮、磷、砷、锑、铋五种元素.根据原子结构和周期律理论,它们的结构和主要的化学性质等,都应有很多的类似性和规律性
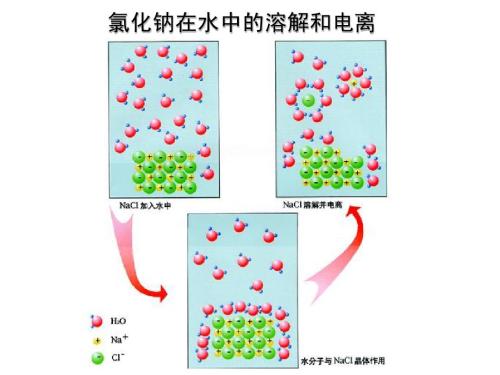
- 如何区分强电解质与弱电解质

- 如何区分强电解质与弱电解质,在上一节里我们讲到酸溶波显现的某些通性,是各种酸类在水溶液里共有的氢离子的性质,但是,不同酸溶液在显现这些性质时,在程度上却有很大的不同.例如,在盐酸溶液(即使是很稀的)里滴入紫色石蕊试液液,立刻看到溶液变成红色,现象十分明显;但在相同浓度的氢氯酸①溶液里滴入紫色石蕊试液,溶液颜色变红的现象却很不显著,有时甚至不易辨别出来。
之前讲过,酸类可以根据它们酸性的强弱,分成强酸和弱酸两类.盐酸、硫酸、硝酸等是强酸,碳酸、醋酸、氢硫酸等是弱酸。
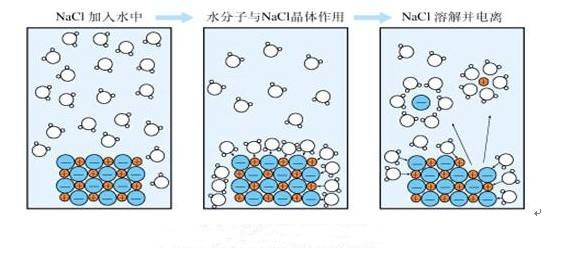
- 电离的种类及特点
- 电离的种类及特点,我们已经知道,碱类、酸类和盐类都是电解质,它们在水溶液里都能电离生成自由离子.但是碱类、酸类和盐类是不同种类的电解质,它们在水溶液里电离生成的离子当然也是不同的.在本节里,我们将讨论这几类电解质在水溶液里的电离,从而进一步从本质上来认识它们的性质
- 什么是硅的化合物

- 什么是硅的化合物,硅是一种非金属元素,构成地壳的岩石和许多矿物中都含有硅元素.所以它在自然界里存在的量很大,在所有的元素中仅次于氧。
在元素周期表里硅的位置是在第三周期第Ⅳ主族.它和碳元素属于同一族一一碳族.因此,它们的性质在很多方面都非常相似.它们都有很多的化合物,而且都很重要;碳是构成有机体的主要元素,而硅是构成地売、矿物界的一种重要元素
- 离子的化学性质

- 离子的化学性质,离子和相应原子在结构上的这种差别,使得离子和相应原子(或者由原子组成的分子)的性质完全不同.例如在氯化钠(NaCI)的水溶液里,存在着Nat离子和Cl-离子.当我们比较氯化钠溶液和由钠原子组成的金属钠、由氯分子(它是由两个氯原子构成的)组成的单质氯气的性质时,立刻就能看到它们在很多方面都是不相同的
- 发现电离学说的主要论点
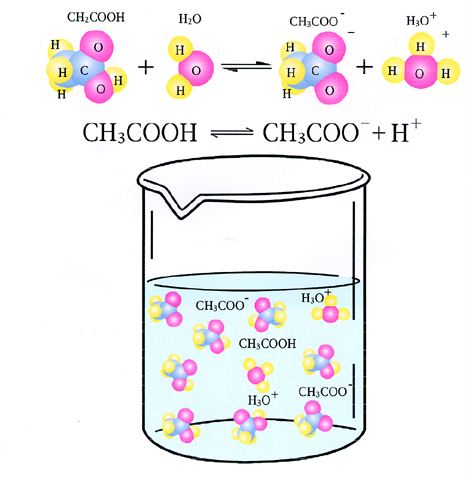
- 发现电离学说的主要论点是它在一定条件下电离生成自由离子的结果.其实,在近代物质结构理论尚未提出以前,科学家已经对电解质溶液(或熔液)的导电现象作了各式各样的解释释,其中比较成功的是1887年瑞典科学家阿伦尼乌斯提出的二个假设.后来阿伦尼乌斯自己和其他许多科学家又在实验的基础上,进一步论证和发展了这个假设,成为比较完整的学说,称做电离学说.
- 水的化学物理性质

- 水的化学物理性质:水的分解水是由氢、氧两种元素组成的一种性质比较稳定的化合物,在水分子里,氢原子和氧原子的结合十分牢固.
- 置换反应的定义
- 置换反应的定义,一种单质(锌)和一种化合物(硫酸)相互作用,生成一种新的单质(氢气)和新的化合物(硫酸锌),象这种类型的化学反应,称做置换反应.





