镧系元素共有十五种。它们之所以全都挤在周期表的同一位置,是因为这十五种元素最外层轨道的电子数量完全相同,次外层的电子数量也基本相同,只有从外往里数第3层轨道的电子数不一样,因此这一行元素的性质极为相似。
怎么会有这么神奇的事?结合“量子数法则”,理解起来就不成问题了。
电子轨道由“主量子数n”、“角量子数l"和“磁量子数m”这三个变量决定。而且这三个数字要遵循下列四条原则:
原则1:主量子数n=1、2、3……
原则2:角量子数l=0~n-1
原则3:磁量子数m=-l~+l
原则4:每个轨道最多可容纳2个电子
电子轨道根据主量子数与角量子数命名。
主量子数直接使用n的数值即可。
角量子数就稍微复杂一些:s轨道、p轨道、d轨道、f轨道分别代表角量子数l=0,1,2,3的轨道。
如果主量子数n=1,角量子数l=0,那么这条轨道就是“1s轨道”。如果主量子数n=2,角量子数l=1,那么这条轨道就是“2p轨道”。
请大家注意,电子不一定会先排入主量子数小的轨道。如果角量子数够大,轨道的能量水平就有可能颠倒。比如,电子会先进入4s轨道,而非3d轨道,因为前者的能量更低。
过渡元素就是这样产生的。
过渡元素先填满最外层的4s轨道,再把靠内的3d轨道上的空位逐一填满。由于元素的性质基本是由最外层的电子排布方式决定的,所以这一系列元素体现出了相似的金属性质。
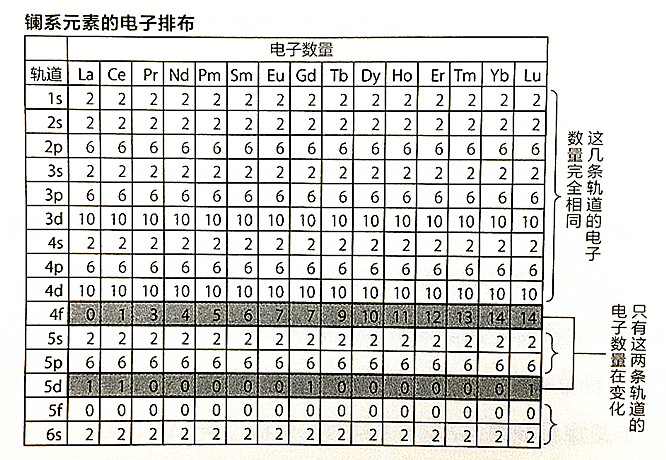
而稀土元素以更显著的形式体现出了这一特征。位于周期表第6周期、第3列的15种镧系元素,占了稀土元素的大部分名额。其中原子序数排在首位的57号元素才是真正的镧,只是其余14种元素与它的性质非常相似,才被统称为镧系元素。
为什么其余14种元素的性质会和镧这么相似?瞧瞧它们的电子排布就知道了。
如上图所示,镧系元素的差异在于4f轨道,而外侧的5s与5p轨道都座无虚席(有几种元素的5d轨道没有填满)。更靠外的6s轨道也有2个电子,没有空位了。
根据薛定谔方程,可知与最外层的6s轨道及次外层的5s轨道、5p轨道相比,从外往里数第3层的4f轨道的能量更高。轨道的能量水平颠倒了。
所以镧系元素的最外层与次外层都是满的,只有从外往里数第3层的电子数量不同。不难想象,这群元素的相似性比普通的过渡元素更甚。
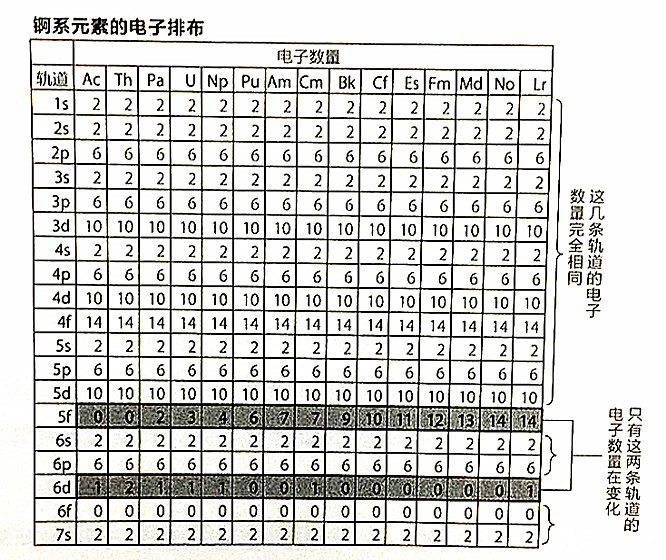
第7周期的锕系元素也是如此。如图所示,锕系元素的区别在于5f轨道,而靠外的一层,除6d轨道有部分例外,6s与6p轨道都被电子填满了。更靠外的7s轨道也没有空位。因此到103号元素为止的14种元素都和89号元素“锕”有极其相似的性质。
第6周期与第7周期的“平行美”。用简明的图表体现出电子轨道孕育的均衡秩序,正是元素周期表隐藏的特征。
感谢您观看浏览这篇文章,999化工商城https://www.999gou.cn永远欢迎您,收藏一下吧宝贝
