











![1,5-二氮杂双环[4.3.0]壬-5-烯 DBN](images/202306/thumb_img/5107_thumb_G_1688093666688.jpg)

氮主要以单质状态存在于空气中。除了土壊中含有一些铵盐、硝酸盐外,氮以无机化合物形式存在于自然界是很少的。而氮普遍存在于有机体中,它是组成动植物体的蛋白质的重要元素。
工业上大量的氮是从分馏液态空气得到。常以15.2MPa(150 atm)压力装入钢瓶中备用。实验室里可加热氯化铵饱和溶液和固体亚硝酸钠的混合物来制备氮。
NH4Cl+NaNO2=NH4NO2+NaCl
NH4NO2=(加热)N2↑+2H2O
得到的N2中仍含有一定量NH3、NO、O2和H2O等杂质。
将氨通过红热的氧化铜,可得较纯的N2。
2NH3+3CuO=3Cu+N2↑+3H2O
氮是无色无臭的气体,密度为1.25g·L-1,熔点为63K,沸点为77K,临界温度为126K,因此,它是个难于液化的气体。在水中溶解度很小,在283K时,大约一体积水可溶解0.02体积的N2。N≡N的键能很大(946kJ·mol-1),是单键N-N(155kJ·mol-1)强度的六倍左右。加热到3273K时,只有0.1%离解。它在高温时不但能和某些金属或非金属(如锂、镁、钙、铝、硼等)化合生成氮化物,也能与氧、氢直接化合。

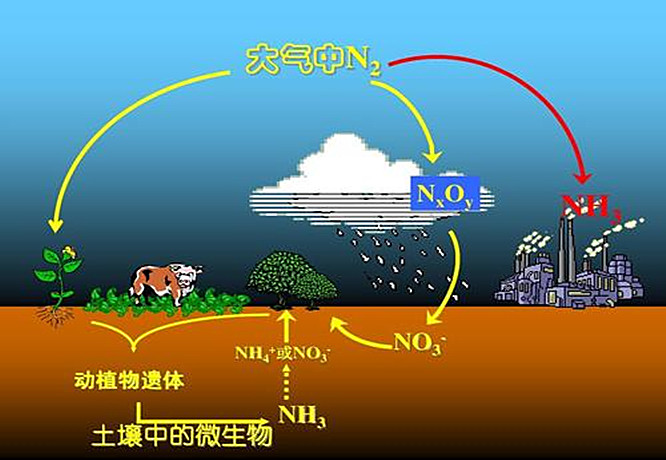
把空气中的N2转化为可利用的含氮化合物叫做固氮。如合成氨、氰氨法都是常用的人工固氮方法。雷雨闪电时生成NO以及某些细菌特别是根瘤菌把游离态氮转变为化合态的氮都是自然界中的固氮。人工固氮既消耗能量,产量也很有限。有人估算过,全世界靠化学工业每年的固氮量,只能达到生物固氮的四十分之一左右。
固氮的原理就是使N2活化,削弱N=N原子间的牢固三重键,使它容易发生化学反应。削弱的办法有两种:一是把N2成键轨道中的电子取走,即减少两个N原子间的电子云密度,使它们的结合减弱;另一办法是向N2的反键轨道中充填电子,抵销成键效应以削弱N原子间的结合。但N2的最高被占轨道(σ2p和π2p)的能量(-1504kJ·mol-1和-1614KJ·mol-1)是很低的,电子不易被激发,即N2难被氧化;同时N2的最低空轨道(π2p*)能量(788kJ·mol-1)较高,所以不容易接受电子而被还原。这样给人工固氮带来很大的国难,对比起来生物的圆氮是容易得多。因此,人们长期以来一直盼望能用化学方法模拟圆氮菌实现在常温常压下进行固氮。这方面的研究工作,主要有过渡金属配合物催化固氮体系的研究,分子氮配合物的研究,以及固氮酶活性中心棋型化合物的研究。从60年代开展以来,已经取得一定的成绩,但仍然是一个重要的科学研究课题。
氮主要用于合成氨,由此制造化肥、硝酸和炸药等。由于氮的化学惰性,常用作保护气体,以防止某些物体暴露于空气时被氧所氧化。此外,用N2充填粮仓可达到安全地长期保管粮食的目的。液态氮可作深度冷冻剂。
