




元素的氢氧化物在周期开始是由金属离子和氢氧根离子组成的。举例来说,NaOH是由Na+和OH-离子组成的,氢氧化钙是由Ca2+和OH-组成的。当这些离子型氢氧化物溶解在水中时,它们向水溶液供供给了氢氧根离子因而叫做碱:我们说它们是具有碱性的物质。那些生成低电荷大半径正离子的元素,它们的氢氧化物的碱性是特别显著的。另方面,每一周期末尾的非金属元素的氢氧化物在溶液中电离给出氢离子因而叫做酸酸。举例来说,氯和氮的氢氧化合物就是这种情况:
HOC1→H++OC1-
HONO2→H++ONO2-
氢氧化物的酸性或碱性,可以认为是由于各种元素的电负性不同而引起的。一般而言,氢氧化物可以看作是一种元素E同一个或多个氢氧根相结合(参见下面的化学式)。如果E有相对较低的电负性,它对电子的吸引力较小,它同氧原子形成强共价键的倾向很小,因而该元素与氧之间的键弱于氢与氧之间的键。因此,在a处的键是离子键键,它对溶液给出氢氧根离子,该物质表现为碱。对元素E来说大半径、小核电荷和低氧化数是在低电负性方向上起作用的因素,这是金属性较强元素的特征。
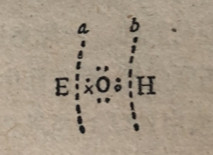
另一方面,如果元素E有相对较高的电负性,它颇为强强烈地吸引着它同氧之间的共用电子对,而在元素E同氧原子之间形成相对较强的键。因此氧氢键由于电子向E方面偏移而减弱,在b处的键是离子键,向溶液给出氢离子,该物质表现为酸。小半径、大核电荷和高氧化数是在高电负性方向上起作用的因素,它们是非金属性较强元素的特征。
在周期表上划分金属与非金属的对角线附近的中间元素,它们的氢氧化物往往是两性的,这表明这些氢氧化物与强碱作用时是酸,而与强酸作用时是碱。
AI(OH)3+OH-→[A1(OH)4]-
Al(OH)3+3H+→A13++3H2O
氢氧化铝在强酸或强碔中的可溶性反映了它的两性性质。在强碱中,相对难溶的AI(OH)3与氧根离子作用转化成可溶的
[A1(OH)4]-丁离子;而在强酸中A1(OH)3同氢离子作用转化成可溶的Al3+离子。
