氢氧化钾
性质
中文名:氢氧化钾
别称:苛性钾、苛性碱、钾灰
化学式:KOH
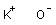
分子量:56.1
CAS号:1310-58-3
外观:白色粉末
熔点:380℃
沸点:1324℃
密度:2.044g/cm3
溶解性:易溶于水,溶于乙醇,微溶于醚
规格型号:25kg/包
质检信息
质检项目 指标值
含量,% ≥90~95%
澄清度试验, 4
氯化物(Cl) 0.01
硫酸盐(SO4) 0.005
总氮量(N) 0.001
磷酸盐(PO4) 0.005
硅酸盐(SiO3) 0.02
碳酸盐(以K2CO3计) 1.5
钠(Na) 2.0
铝(Al) 0.005
钙(Ca) 0.005
铁(Fe) 0.001
镍(Ni) 0.0005
重金属(以Pb计) 0.002
化学特性
氢氧化钾俗称苛性钾,白色固体片状,密度:1.450 g/mL at 20 °C,熔点:361 °C(lit.)沸点:1320°C,闪点:52 °F,折射率:n20/D 1.42,溶于水、醇,但不溶于醚。在空气中极易吸湿而潮解。可与二氧化碳反应生成碳酸钾。所以它会被用作吸收二氧化碳之用。 氢氧化钾是典型的强碱,有许多工业上的应用,大部分的应用都是因为氢氧化钾可以和酸反应,有极强的碱性和腐蚀性,其性质与烧碱相似。中等毒,半数致死量(大鼠,经口)1230mg/kg。也用来制备含钾的化学物质。
1.碱性反应
可使石蕊试液变蓝、酚酞试液变红。
2.与酸反应
KOH+HCl=KCl+H₂O
2KOH+H₂SO₄=K₂SO₄+2H₂O
KOH+HNO₃=KNO₃+H₂O
3.与酸性氧化物反应
如与二氧化碳、二氧化硫反应。
2KOH+CO₂=K₂CO₃+H₂O
2KOH+SO₂=K₂SO₃+H₂O
4.与两性金属反应
如与铝反应。
2Al+2KOH+2H₂O=2KAlO₂+3H₂↑
5.与两性氧化物反应
如与氧化铝反应。
Al₂O₃+2KOH=2KAlO₂+H₂O
6.与两性氢氧化物反应
如与氢氧化铝反应
Al(OH)₃+KOH=KAlO₂+2H₂O
7.与过渡元素盐溶液发生复分解反应
CuSO₄+2KOH=Cu(OH)₂↓+K₂SO₄
FeCl₃+3KOH=Fe(OH)₃↓+3KCl
除此之外,氢氧化钾还可以发生其他反应,如与白磷反应生成磷化氢气体。
8.相关化学反应
2KOH+CuCl₂=Cu(OH)₂↓+2KCl
CaO+H₂O=Ca(OH)₂
Ca(OH)₂+K₂CO₃=2KOH+CaCO₃↓(由于KOH是强碱具有溶解蛋白质的性质,因此黑痣被除掉)
6KOH(s)+4O₃(g)=4KO₃(桔红色)+2(KOH·H₂O)+O₂↑
4KOH(s)+4O₃=4KO₃+2H₂O+O₂↑
6KOH+3S=△=2K2S+K2SO3+3H2O
2KOH+SO₂=K₂SO₃+H₂O
KOH+CO₂=KHCO₃(氢氧化钾变质该反应还是生产重要化工原料K₂CO₃的主要手段)
2KOH+H₂S=K₂S+2H₂O
3KOH+C₆H₆Cl₆=C6H₃Cl₃+3KCl+3H₂O(农药666分解反应)
产品用途
1、氢氧化钾用作干燥剂、吸收剂,用于制草酸及各种钾盐,还用于电镀、雕刻、石印术等
2、氢氧化钾主要用作钾盐生产的原料,如高锰酸钾、碳酸钾等。在医药工业中,用于生产钾硼氢、安体舒通、沙肝醇、丙酸睾丸素等。在轻工业中用于生产钾肥皂、碱性蓄电池、化妆品(如冷霜、雪花膏和洗发膏)。在染料工业中,用于生产还原染料,如还原蓝RSN等。在电化学工业中,用于电镀、雕刻等。在纺织工业中,用于印染、漂白和丝光,并大量用作制造人造纤维、聚酯纤维的主要原料。此外,还用于冶金加热剂和皮革脱脂等方面。
3、氢氧化钾用作分析试剂、皂化试剂、二氧化碳和水分的吸收剂。
4、氢氧化钾在日化工业用作制造洗污肥皂、洗头软皂、雪花膏、冷霜、洗发膏等的原料。制药工业用于制造黄体酮、香兰素等原料。染料工业用于制造三聚氰胺染料。电池工业用于制造碱性蓄电池。
5、氢氧化钾用于酸碱中和调节PH(50G/L,25℃)值。
氢氧化钾对混凝土的物理性能的影响
1、抗掺性能。有氢氧化钾的混凝土,它的抗渗标号比未加剂混凝上的抗渗标号要高。
2、混凝土的徐变。掺加氢氧化钾的混凝土的徐变度,比不加剂混凝土的要小,徐变系数也小,故用于预应力混战土时,仍可保留必要的性能。
3、其它性能,对加入氢氧化钾的混凝土的碳化及锈蚀等方面均有过试验报导。一般,在正常使用下,均未发现有不良的影响。
4、混凝土的干缩性能。掺有氢氧化钾的混凝土,在室温下养护时,前二个月的收缩要略大些,三个月以后则掺剂混凝土的收缩要比未加的小些。
5、抗冻融性。掺有氢氧化钾的混凝土,其容重比未加时要大,说明其密实性好,因而抗冻融性能要好。
以上五点就是氢氧化钾对混凝土的物理性能的影响,另外氢氧化钾具有引湿性,在潮湿的阴雨天气会吸潮结块。
氢氧化钾生产方法
1.隔膜电解法原料氯化钾在化盐槽溶化成饱和溶液,加热至90 ℃时分别加入碳酸钾、苛性钾、氯化钡除去钙、镁和硫酸根等杂质,经沉降除渣、盐酸中和、精制的含氯化钾280~315 g/L的氯化钾溶液经预热到70~75 ℃后进行电解,得氢氧化钾、氯气和氢气。隔膜法所得氢氧化钾浓度为10%~11%,需通过蒸发浓缩和冷却澄清,制得含45%~50%氢氧化钾溶液;也可继续在熬碱锅中浓缩,经脱色,制得固体氢氧化钾,或经制片成片状氢氧化钾产品。
2.水银电解法电解液的配制同隔膜电解法。电解室中以石墨(或金属)作阳极,水银作阴极,电解产生的氯气送氯气干燥工序,生成的钾汞齐流入解汞室。大部分未反应的氯化钾以淡盐水状态经处理后,返回原料溶解工序。钾汞齐与清水反应生成氢氧化钾和氢气。因解汞室出来的氢氧化钾浓度为45%~50%,可作为液体氢氧化钾产品,也可再经熬碱锅蒸浓成固碱或制成片状氢氧化钾产品。
3.工业上制取氢氧化钾是电解氯化钾的水溶液。因为氢氧化钾比氢氧化钠难脱水,市售品的纯度一般只能达到85%~86%。如需提纯可按照提纯氢氧化钠的相同的方法进行提纯。
4.氯化钾经精制后,预热,不断注入电解槽中,电解生成液经浓缩、脱色而得。
5.采用离子交换膜法,以工业品氢氧化钾作为阳极室物质,纯水作为阴极室物质,在直流场作用下,K+离子透过具有选择性的阳膜进入阴极室与OH-离子生成试剂氢氧化钾,经浓缩、干燥得固体氢氧化钾。气体产物 O2 、H2 分别由导管排出。
氢氧化钾的合成原理
1.隔膜电解法原料氢氧化钾在化盐槽溶化成饱和溶液,加热至90℃时分别加入碳酸钾、苛性钾、氯化钡除去钙、镁和硫酸根等杂质,经沉降除渣、盐酸中和、精制的含氢氧化钾280至315g/L的氢氧化钾溶液经预热到70至75℃后进行电解,得氢氧化钾、氯气和氢气。隔膜法所得氢氧化钾浓度为10%至11%,需通过蒸发浓缩和冷却澄清,制得含45%至50%氢氧化钾溶液;也可继续在熬碱锅中浓缩,经脱色,制得固体氢氧化钾,或经制片成片状氢氧化钾产品。
2.水银电解法电解液的配制同隔膜电解法。电解室中以石墨(或金属)作阳极,水银作阴极,电解产生的氯气送氯气干燥工序,生成的钾汞齐流入解汞室。大部分未反应的氢氧化钾以淡盐水状态经处理后,返回原料溶解工序。钾汞齐与清水反应生成氢氧化钾和氢气。因解汞室出来的氢氧化钾浓度为45%至50%,可作为液体氢氧化钾产品,也可再经熬碱锅蒸浓成固碱或制成片状氢氧化钾产品。
3.工业上制取氢氧化钾是电解氢氧化钾的水溶液。因为氢氧化钾比氢氧化钠难脱水,市售品的纯度一般只能达到85%至86%。如需提纯可按照提纯氢氧化钠的相同的方法进行提纯。
4.氢氧化钾经精制后,预热,不断注入电解槽中,电解生成液经浓缩、脱色而得。
5.采用离子交换膜法,以工业品氢氧化钾作为阳极室物质,纯水作为阴极室物质,在直流场作用下,K+离子透过具有选择性的阳膜进入阴极室与OH-离子生成试剂氢氧化钾,经浓缩、干燥得固体氢氧化钾。气体产物O2、H2分别由导管排出。
储存注意事项
1.储存于阴凉、干燥、通风良好的库房。远离火种、热源。库内湿度最好不大于85%。
2.包装必须密封,切勿受潮。应与易(可)燃物、酸类等分开存放,切忌混储。
产品信息 [产品信息] 25kg [级别] 工业级
