















































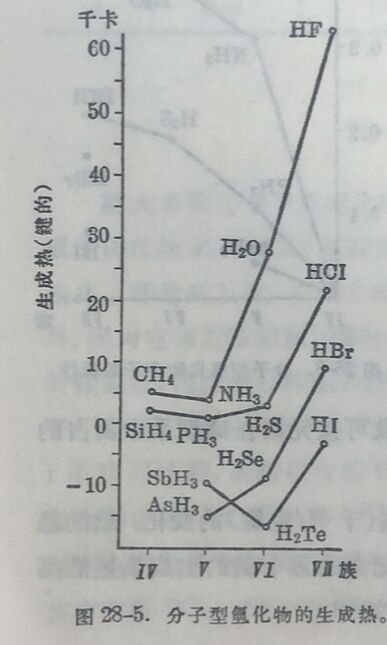
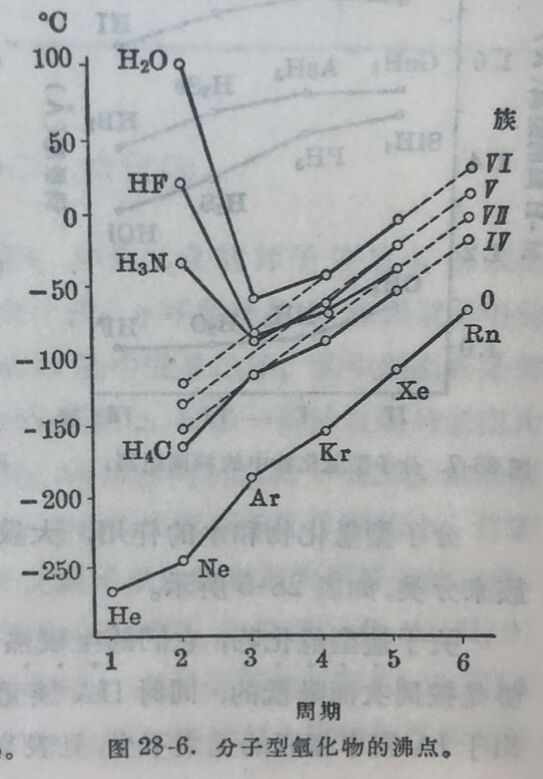
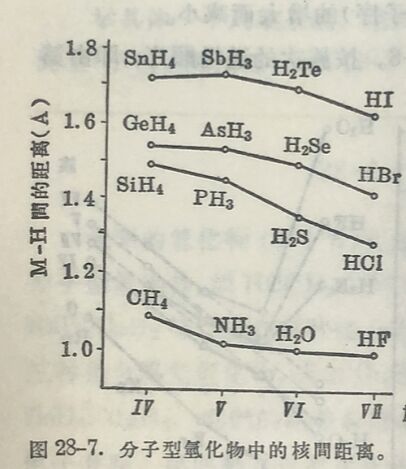
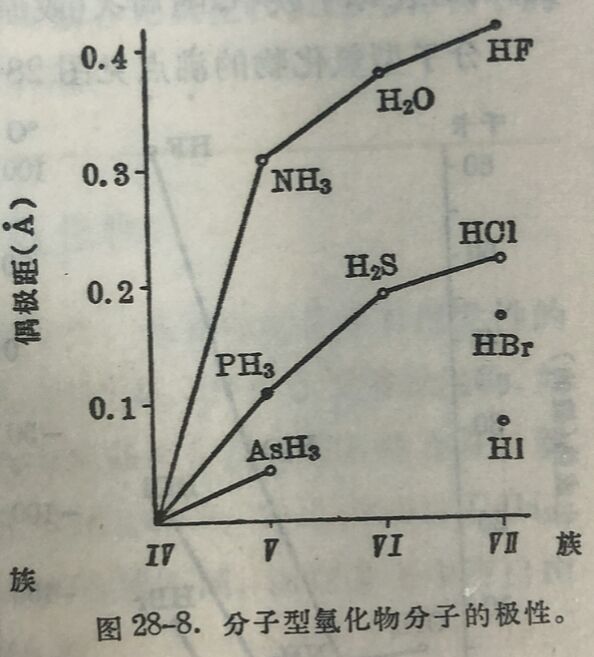
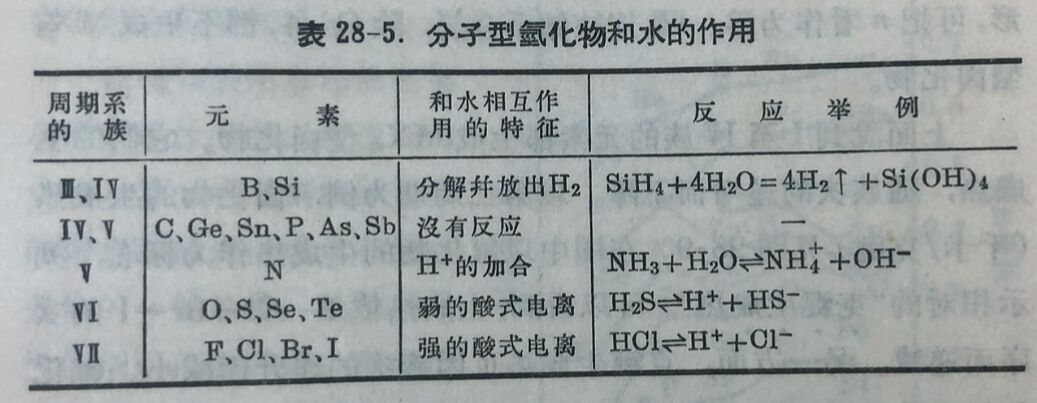
元素的氫化物共分四类。最普通的是具有揮发性的分子型氫化物,如HCl、H₂O、NH₃、CH₄等,其次是盐型氫化物,如NaH、CaH₂等,氢在这些化合物中以负一价离子形式而存在。第 三种是金屬型氫化物,例如CuH、NiH₂、CoH₂、FeH₂、ZnH₂、CdH₂、BeH₂、MgH₂,它們的晶格和原来的金屬不同,而在晶格中有自由电子存在。第四种是过渡氫化物,如
| LaH2.76 | TiH1.73 | PdH0.6 |
| CeH2.69 | ZrH1.98 | |
| PrH2.85 | TaH0.78 |
| IIA | IVA | VA | VIA | VIIA |
|
B — Ga — — |
C Si Ge Sn Pb |
N P As Sb Bi |
O S Se Te Po |
F Cl Br I — |
| 周期 | IA |
生成热
(千卡/克键)
|
IIA |
生成热
(千卡/克键)
|
|
2 3 4 5 6 |
LiH NaH KH RbH CsH |
21.6 13.9 14.1 13.0 13.5 |
— CaH₂ SrH₂ BaH₂ — |
— 23.3 21.1 20.5 — |