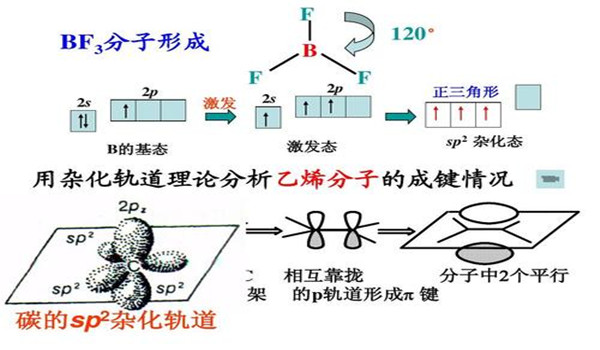
激发态的产生的构造原理光和分子的相互作用
化学先生 / 2019-08-24
1.构造原理
电子在原子或分子中排列分布所遵循的原理包括:能量最低原理、保利(Paul) 不相容原理和洪特(Hund)规则。
能量最低原理:自然界一个普遍的规律是“能量越低越稳定”。原子中的电子也是如此。在不违反保利原理的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
保利(Pauli) 不相容原理:在一个原子中没有两个或两个以上电子具有完全相同的四个量子数(在主量子数n、角量子数l、磁量子数ml、自旋磁量子数ms表象中的表达)。或者说一个原子轨道上(主量子数n、角量子数l、磁量子数ml相同时)最多只能排两个电子,而且这两个电子自旋方向必须相反。
洪特规则:在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。
2.光和分子的相互作用
现代光学理论认为,光具有波粒二象性。光的微粒性是指光有量子化的能量,这种能量是不连续的。光的最小能量微粒称为光量子,或称光子。光的波动性是指光线有干涉、衍射和偏振等现象,具有波长和频率。光的波长λ和频率v之间有如下的关系:
ν=c/λ
其中c为光在真空中的传播速度(2.998×10正8次方m/s)。
光是电磁波的一 部分,可用在相互垂直的平面内以正弦波的方向振动,其能量可表示为:
E=hv
其中h为普朗克常数: v是频率。
原子或分子中的电子同样具有波动性,可与光波相互作用,其相互作用分为电场相互作用和磁场相互作用
e[Hυ]
F=eε十───≈eε
c
e是一个电子所具有的电荷,ε是电场强度,H是磁场强度,υ是电子运动的速度。由于光速远大于电子运动的速度。故光波与电子的相互作用F主要由电场力项所决定,磁场力通常要小得多。原子或原子团的直径通常为2~ 10A(1A=0.Inm),通过如下简单的计算我们可以知道可见光与分子的相互作用时间一一即光波通过原子团的时间大约为10负18次方s。例如设原子的直径是3A,即, 3×10 负10次方m,光速是3×108次方m/s.所以作用时间是: t=L/e=1×10负18次方s。
这个时间较有机分子最快的运动C─H键的伸缩运动所需要的时间还短。C─H健的伸缩运动的频率为10正13次方s-1次方。所以完成一次伸缩运动所需要的时间为10负13次方s。
而电子在玻尔轨道上做一 次循环运动所需要的时间是10负15次方s,即在光和分千发生相互作用的时间内,分子的构型来不及改变,但对于电子完成轨道跳跃却有足够的时间保证基态分子中的电 子处于尽可能低的轨道中,要使电子从低能轨道跃迁到高能轨道,光波必须赋子电子足够的能量。激发一个电子所需 要的能量为:
hc hc
△E=E2-E1=hν=一 或 λ=一
λ △E
E1和E2分别是电子跃迁前后所占据的轨道的能量,ν和λ是光波的频率与波长。
编辑网站https://www.999gou.cn 999化工商城