


























第三节催化剂的比表面和孔结构的测定
在第一章中曾经指出,在没有扩散影响的情况下,固体化剂的活性和选择性决定于它的化学组成和结构。然而对大多数工业催化剂来说,由于它的多孔结构和具有一定的颗粒大小,在生产条件下,反应常常受到扩散的影响。这时化剂的活性,选择性和寿命都与孔结构有关。
一、催化剂的比表面和孔结构与化性能的关系
1.比表面与活性
当催化剂的化学组成和结构一定时,在化学动力学区内单位重量(或体积)催化剂的活性决定于它的比表面的大小。
表3-3为2,3-二甲基丁烷在硅酸铝催化剂上527℃时裂解反应的数据。由不同方法得到的硅酸铝的比表面,相差最大有10倍,而它的裂解活性也相差10倍。活化能则始终保持不变。活性与比表面成正比关系,见图3-32。
.png)
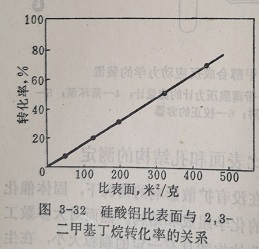
在硅酸铝催化剂上进行的烃类裂解反应,常可观察到上述直线关系。可以认为在这种化学组成一定的催化
剂的表面上,活性中心是均匀分布的。但是,由于制备方法的不同,许多催化剂的活性与其比表面并不能成简单的正比关系。
尽管如此,比表面仍是催化剂的最重要的性质之一。在研究各种物质的固有催化性能时,常以比活性(单位面积上呈现的活性)作为比较的基础。在工业催化剂的制备研究中,也离不开比表面的数据。例如在比较不同组成或组成相同而制法不同的催化剂的活性时,如果考虑到不同样品比表面的差异,就能确定单位重量催化剂活性的不同究竟是由于比表面的变化,还是由于单位表面积上的活性改所致。这对催化剂的研制具有指导意义。
通常,对反应速度小的、生成物在反应条件下稳定而且不发生连续反应的过程,采用高比表面和小孔径的催化剂是有利的。
2.孔结构与活性和选择性
当化学反应在动力学区进行时,催化剂的活性和选择性与孔结构无关。但是,当反应分子由颗粒外部向内表面扩散或当反应产物由内表面向颗粒外表面扩散受到阻碍时,催化剂的活性和选择性就与孔结构有关。大多数工业催化过程都处于这种条件下。关于扩散对反应速度的影响,本章第一节已详细讨论过。这里仅举几个孔结构对活性和选择性影响的例子。
(1)孔结构对活性的影响 很多研究工作者发现,燃料油脱硫催化剂的活性与孔结构有密切的关系,并导出了各种形式的活性与催化剂孔结构因素的关系式。
锡尔和惠勒用中东直馏汽油,在375℃、35大气压进行脱硫反应时,求得了催化剂的活性和孔结构之间的如下关系式:
㏑C入/C出=3S(KD*r)½/SvR2½
式中 C入一一反应器进口原料油中硫的浓度;
C出一一反应器出口物料中硫的浓度;
S一一催化剂比表面,米2/克;
K一一反应速度常数,厘米/秒;
D*一一硫化物在孔内的有效扩散系数,厘米2/秒;
r一一平均孔半径,Å;
Sv一一空间速度,小时^-1;
R一一催化剂颗粒半径,厘米。
由上式可以看出,当比表面和孔半径増大时,上式左端的数值也增大,即催化剂的活性也升高。
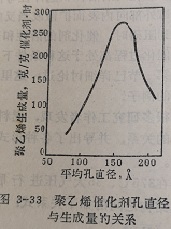
不仅反应物向孔内的散,能影响反应速度,而且反应产物的逆扩散,同样也能影响反应速度。即孔径也影响这类反应的表观活性。中压法乙烯催化聚合反应就是一个例子。聚乙烯的生成量与催化剂平均孔径的关系绘于图3-3。当催化剂平均孔径为160Å时,化剂的活性最高。曲线的形式可以这样解释,化剂既需要具有足够的内表面以便进行乙烯的聚合反应,又必须供使生成的大分子量聚乙烯向外逆扩散的足够大的孔径。
(2)孔结构对选择性的影响 在扩散作用的影响下,催化剂的选择性也与孔结构有关。以下分别讨论三种类型的反应。
a.两个无关的平行反应
A k1→B+C
x k2→y+z
式中k1、k2为表观速度常数。
烯烃和芳烃混合物的加氢属于这类反应,人们希望烯烃加氢,而不希望芳烃加氢。为了便于说明起见,假定上述两个反应级数都是一级,则相应的反应速度为
-dA/dt=k1A
-dx/dt=k2A
上式除以下式,然后积分得
αA=1-(1-αx)^s
式中αA和αx,分别为反应物A和x反应了的分数。S为速度常数的比值k1/k2。对于一定的α值,反应了的A的百分数仅与S有关。因为S值表征催化剂的选择性,所以称S值为选择因子。在实验中改变接触时间,以log(1-αA)对g(1-αx,)作图,由直线的斜率得S。
如无扩散影响时,则
k1=kA,k2=kx
或S=k1/k2=kA/kx
式中k1和k2为不受扩散影响的真实的化学反应速度常数。这时反应速度快的对总过程来说,选择性也高。
当反应受内扩散速度控制时,实测的反应速度不与真实的化学反应速度常数成正比,而是与其平方根成正比,这时k1正比于kA½ k2正比于kx½ ,如果这两种反应物的扩散系数接近,则
S=k1/k2=(kA/kx)½
即选择因子为无扩散影响时的度常发平方根。如果A的反应速度比的反应速度比x快,则由于扩散影响,A反应表面利用率的降低,要比x反应表面利用率快的多而使反应的选择性下降了。
所以对这类反应,小孔径催化剂有利于慢应选择性的提高,而使快反应的选择性下降。
b.同一种起始物质的平行反应
乙醇脱氢可生成乙醛,也可以脱水生成乙烯,乙烯可以氧化为环氧乙烷,也可以氧化为CO2。如果这两个反应都是一级反应仿前可得:
αB=Sαc
式中αB和αc分别为反应物A变成B和C的分数,S为k1/k2。
在两种情况下,如果两个反应的级次相同,则不论是否存在内扩散阻碍,反应的选择性是不受影响的。这是因为在孔内表面的每一点上,两个反应都按相同的速度比k1/k2进行,而与A的分压无关。若B为所希望的产物,其得率为k1/(k1+k2),而与催化剂孔的大小无关。
然而,当这两个相互竞争的反应级数不同时,则选择性与孔的大小有关。在孔中A的分压的下降,对这两个竞争反应速度数影响不同。对级次高的反应影响大,对级次低的影响小。所以孔径越小,越促使级次高的反应的选择性下降反之,对级次最的反应,选择性则可提高。
c.连续反应
![]()
这类反应在有机化学中最常见,也最重要。所需要的产物常常是比较不稳定的中间产物。例如有机物的氧化反应属这一类,反应产物容易进一步的氧化为CO2和HO。乙炔选择加氢为乙烯的反应也属这一类,因为乙烯较不稳定,容易加氢为乙烷当不存在散影响时,即孔径足够大时,有关的反应速度方程可以写成:
-dA/dt=k1A
dB/dt=k1A-k2B
二式相除,得
dB/dA=1-B/SA
式中 S一选择因子,等于k1/k2。
对上式积分得:
αB=S/S-1(1-αA)[(1-αA)^-(1-1/S)]-1)
式中αB一反应了的A转化为B所占的百分数,即B的单程收率;
αA一反应了的A的百分数;
S一k1/k2,选择因子。
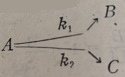
在无扩散影响时,对于一定的k1/k2值,上式即确定了αB与αA的关系。例如当连续反应两个阶段的速度常数比为4时,αB与αA的变化关系如图3-34中的曲线1。曲线1的极大值,相当于A的转化率为80%,A变为B的转化率为62%。B在这一点的选择性为62/80=78%。
但是,对于有内扩散影响的小孔径化剂,可以得到
LN]N[IRD_8M0Q`~5SRQXM.png)
积分可得
![]()
若k1/k2=4,则αB与αA的变化关系如图3-34曲线2所示。极大值的位置相当于αB=33%。αA=75%。这时B的选择性αB/αA=40%。
由此可见,在小孔径催化剂上生成B的选择性必然降低。这是因为在小孔化剂中生成的不稳定中间产物,不容易扩散到孔外来。在扩散的过程中,容易进一步转化为反应最终产物,这就导致了选择性的下降。
催化剂的孔结构对活性和选择性的影响,是工业催图3-34孔径大小对连续反应选催化剂制备中最复杂的问题之一。为了研制出工业上优良的催化剂,除了掌催化剂制备技术外,还应当了解催化反应的动力学,以便根据反应的特点来研制具有最适孔结构的化剂。
3.孔结构与寿命
催化剂的寿命一般决定于它的耐热、耐毒和抗粉化的能力化剂的这些性能都与孔结构有关。
(1)孔结构与耐热性催化剂的耐热性是影响催化剂寿命的重要素。特别是在高温、高压下操作的催化剂,其寿命常决定于它的热性。多孔催化剂的耐热性又与孔结构有密切联系这种关系是复杂的。因为多孔物质烧结的难易,还随固体物质的种类和成孔的方式而异。
有人实验测定了氧化铝的孔结构与烧结速度的关系,并物第出下列的烧结速度公式。
dD/Dt(1/D-2ε/R)
式中D一氧化铝的颗粒直径,厘米;
ε一孔隙率;
R一孔平均直径,厘米;
K一常数。
氧化铝通常是由其水合物加热脱去结品水和层间水形成。它具有细孔结构。常用的各种硅酸铝也属于这一类型。用于石油裂化的硅酸铝催化剂,需要周期的在高温下烧焦生,这种操作使比表面降低,孔容积减小,最终导致活性下降。
(2)孔结构与中毒催化剂中毒是影响寿命的另一个重要因素。常见的有两种情况,一种是表面上吸附了毒物分子,另种是外来物质在催化剂上的沉积。后一种情况实际上是对活性表面的简单物理遮盖。在这两种情况下,催化剂的活性降低速度,都与孔径大小有关。
a,均匀中毒
毒物分子均匀的吸附在催化剂的所有表面上。因此单位内表面的活性下降也是均匀的。在均匀中毒的情况下,在小孔径催化剂上速度慢的反应比速度快的反应受到的影响要大些。因为速度慢的反应需要利用更多的已均匀中毒的内表面,而速度快的反应本来就没有利用孔深处的内表面。
b.孔口中毒
毒物仅吸附在孔口处内表面上,使其中毒。孔深处的内表面上,则无毒物,所以仍保持原有的活性在孔口中毒的情况下,对速度快的反应比对速度慢的影响大些,这与前述均匀中毒的情况恰好相反。所以快的反应其速度低的程度也快。
大孔径与小孔径化剂相比,由提高了有效扩散系数,相对的活性降低要小些。
c.物理遮盖
反应的副产物或反应的局外物质的简单物理,也能使化剂的活性下降。这种活性下降的原因是由于催化剂细孔和表面覆盖所致。一般可通过增大孔径和孔容,即可增加承受毒物的容量,从而使有效扩散系数的降低减慢,因而催化剂的寿命得以延长。
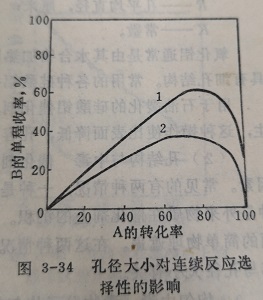
烃类的裂解、重整和脱氢等反应,常常在反应过程中生成和贫氢聚合物,这些物质堆积在孔口附近,阻碍了反应物向催化剂内表面的扩散,使化剂的活性迅想速降低。图3-35是异丙苯在孔径不同的八面沸石、丝光沸石和钙沸石上用脉冲法进行催化裂化时所测定的活性变化。结果表明,孔径9Å的八面沸石的活性随脉冲次数的增加下降不显著,但是孔径小的丝光沸石和钙沸石的活性,则急剧下降。活性下降的原因,是由于伴生的聚合物和积炭堵塞了催化剂的孔口所致。因此对这类反应,在工业上由于大比表面催化剂的孔径小,结焦再生性能差,通常不追求过高的比表面。
4.孔结构与机械强度
固体的机械强度本来是该物质的固有性质。但对多孔催化剂来说,机械强度还与构成颗粒的微晶大小、填充方式和孔納构等因素有关。
一般认为,孔隙率增加、组成颗粒的微粒间接触积减小导致化剂颗粒强度降低的主要原因。柯努森导出了破坏强数微粒直径和孔率的关系式。
σ=kd^ae^-b
式中σ一一破坏强度,达因/厘米^2;
d一一微粒的直径,厘米;
k、a、b一一常数,决定于物质的种类破坏机构和条件。
还有其它一些不同形式的表示强度和孔结构的关系式。总般规律是,催化剂的机械强度不但与孔隙率有关,而且也受孔径大小的影响。因此,如果化剂对反应物和产物有足够的有扩散系数,那么由于强度原因,就不必苛求高的孔隙率和大孔径了。
二、催化剂比表面的测定
对于多孔催化剂,通常需要测定比表的两种数值。一种是总的比表面,另一种是活性比表面。
常用的测定总比表面的方法有BET法和色谱法,测定活性比表而的方法有化学吸附法和色谱法。
1.BET法
当气体靠近其沸点在固体上吸附达到平衡时,气体的吸附量与平衡压力P的关系,可根据多分子层吸附理论导出如下关系式:
V=Vm cP/(Ps-P)[1-(P/Ps)+C(P/Ps)]
式 V一一平衡压力为P时吸附气体的总体积;
Vm一一催化剂表面覆盖单分子层气体时所需气体的体积;
P一一被吸附气体在吸附温度下平衡时的压力;
Ps一一被吸附气体在吸附温度下的饱和蒸汽压力;
c一一与被吸附气体种类有关的常数。
上式称为BET吸附理论方程式。式中。是计算催化剂比表面的基础。为了便于实验上的运算,可将上式写成如下形式
P/V(Ps-P)=1/VmC +(c-1)/VmC·P/Ps
可以看出,以P/V (Ps-P)对P/P作图,可得一直线,直线在纵轴上的截距等于1/VmC,直线的斜率等于C-1/VmC
A=1/VmC
B=C-1/VmC
则
Vm=1/(A+B)
实验时,每给定一个P值,可测定一个对应的V值,这样可在一系列P值下测定值,即可求得Vm值。
有了Vm值后,换算为被吸附气体的分子数。将此分子数乘以1个分子占的面积,即得被测样品的总表面积S:
S=Vm/V NAm
式中 V一一吸附气体的克分子体积,在标准状况下等于22400毫升;
N一一阿佛加德罗常数,6.023×1023;
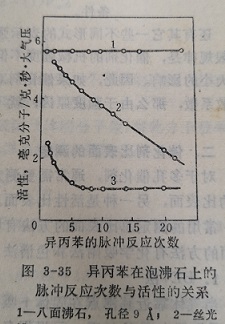
现在最常用的气体是N2,一个氯分子的横截面积一般采用16.2Ų。也有人采用15.8Ų。
为了计算方便,令K=NAm/V则上式可以写成
S=KVm,
式中K一一常数,对于N2,当采用Am=16,2Ų时,K=4.35。
一些常用的吸附质的有关数值列于表3-4。
测定气体吸附量的方法有两种,即容量法和重量法。
(1)容量法
容量法测定比表面是测量已知量的气体在吸附前后体积之差,由此即可算出被吸附的气体量。
在进行吸附操作,要对很化剂样品进行气处理。气处的目的是除去催化剂已吸附的气体。处理条件通常为200~4000和在真空度不低于10毫米汞柱下进行。在保证化剂的结构不发生破坏的条件下,脱气温度可以高些。当脱气操作完成后,系统抽至高真空。通常在真空度高于10-毫米汞柱下,保持足够长的时间。然后进行吸附操作。
如果用为吸附质时,吸附操作在液氮的沸点温度-1950下进行。为此将样品管1放在装有液氮的杜瓦瓶2内(图3-36)。气体量管3要保持恒温。系统的压力用U型压力计4测定。吸附时气的相对压力(P/P)通常在0.05~0.35之间。每给定个(P/Ps)值,当吸附达到平衡时可测得一个吸附量V值。如此测得三对以上的P/Ps和V值,即可按BET方程式给出一直线,从而求得的单分子层吸附量Vm。
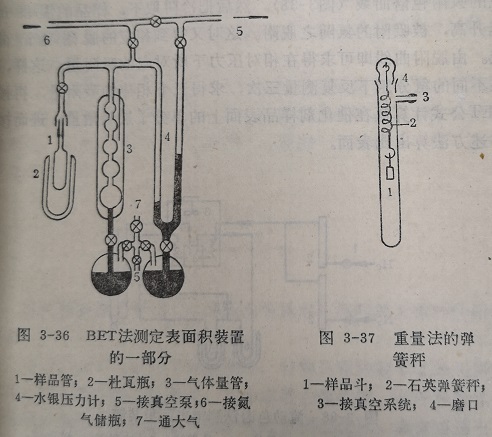
为了提高测定的准确度,所有这些玻璃仪器都要保持良好的恒温,为此通常将仪器放在大的玻璃箱中。
容量法具有很高的精,可以定比表面大于的容量法在操作上又可分为定容法和定压法。定容法是保持体积不变测量吸附前后气体的压力变化。定压法则是保持系统的压力不变,测量吸附前后气体容积的改变。
(2)重量法
重量法的原理是用特别设计的方法秤量催化剂样品吸附的气体量。它与容量法不同,不是测量系统的压力和容积,通过BET方程式计算吸附量,而是采用灵敏度高的石英弹簧秤,由于样品吸附微量气体后的伸长直接测量出来,见图3-37石英弹簧秤要预先校正。除测定吸附量外,其它操作手续与容量法一样。
重量法能同时测量若干个样品(由样品管的套管数而定),所以具有较大的工作效率。但限于石英弹簧的灵敏度和强度;量的准确度比容量法低的多,所以通常用于比表面大于50米²样品的测定。
2.气相色谱法
上述BET容量法和重量法,都需要高真空装置,而且在测量样品的吸附量之前,要进行长时间的脱气处理。不久前发展的气相色谱法测量化剂的比表面,不需要高真空装置,而且测定速度快,灵敏度也较高。
气相色谱法测定比表面常用热脱附法。而热脱附法的理论基础,仍然是根据多分子层吸附理论导出的BET方程式。
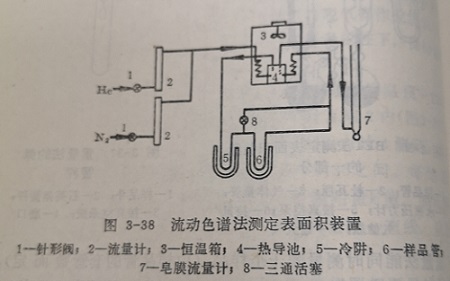
热脱附法的实验置如图2所示。通常用气为吸附质,以氯为载气,配成一定组成通入系统。当催化剂的样品冷却到液温度(-195℃)时,氮即被样品吸附,这时记录仪上给出了应的吸附色谱曲线(图3-38)。然后把冷阱取下,样品的温度速升高,被吸附的氮随之脱附。这时又得到相应的脱附色语线。由脱附曲线即可求得在相对压力下所对应的吸附量。这样,在不同的氮分压下反复测量三次,求得三个相应的吸附量,再按BET公式计算氮在催化剂样品表面上的单分子层吸附量。进而前述方法算出比表面。
三、复杂催化剂不同表面的分别测定
工业催化剂大多数由两种以上的物质组成。每种物质在催化反应中的作用通常是不相同的。人们常常希望知道,每种物质在催化剂中占有的表面积,以便改善催化剂的性能和工厂操作条件,以及降低催化剂的成本。
用上述基于物理吸附原理测定比表面的方法,只能测定催化剂的总表面积,不能测定不同物质的表面积。因此,常常利用有选择性的化学吸附,来测定不同组份所占的表面积。
由第一章可知,气体在催化剂表面上的化学吸附与物理吸附不同,它具有化学反应的性质,对催化剂的某种表面有选择的能。因此,没有一个适用于测定各种不同成份催化剂表面积的通用方法,而是必须用实验来寻找在相同条件下只对某种组份发生化学吸附而对其它组份则是情性的气体;或者同一气体在这些组份上都能发生化学吸附,但吸附的程度不同,也可以求得不同组份的表面积。
用化学吸附方法测定时,必须知道化学吸附的机理,才能进行正确的计算。例如氢在Pt/A2O上的化学吸附,伴随着氢分子的离解,催化剂表面的每个Pt原子上吸附一个氢原子,而不是个氢分子,即
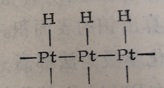
当实验测得了化学吸附消耗的氢量时,即可算出相应的铂原子数。
但是,由于化学吸附的复杂性,目前只有为数不多的几类催化剂,可以进行成功的测定。其中有载在氧化铝、硅胶和活性炭上铂或银催化剂;含助催化剂的合成氨铁催化剂;载在硅藻土上的钻催化剂;载在硅胶上的镍催化剂等。作为例子,以下叙述载于载体上的铂、银催化剂,以及氧化铜与氧化亚铜催化剂的测定方法。
1.载在Al2O3或SiO2-Al2O3上的Pt表面积的测定
在许多有载体的金属铂催化剂中,催化剂的表面,通常并不是全部为P所覆盖。对于Pt/Al2O3和Pt/SiO2-Al2O3催化剂,要想知道P在载体上暴露的表面积,可用H2,O2或CO气体在铂上的化学附法来测定。在化学吸附温度下,这些气体实上不与Al2O3或SiO2-Al2O3载体发生化学作用。
在进行化学吸附之前,催化剂样品要经过升温脱气处理的目的,是将化剂表面上吸附的气体除去,获得清面。脱气处理在加热和抽真空的条件下进行。温度和真空度自愈高,脱气愈完全。温度不能过高,以免晶粒被烧结。
(1)氢的化学吸附法
实验证明,在适当条件下氢在化剂Pt/Al2O3,O上化学吸附达到饱和时,表面上每一个原子吸附一个氯原子,即H/Pt之比等于1。因此,只要选择适宜的化学吸附条件,测定氢在一定量的已知比表面化剂上的饱和吸附量,就能算出暴露在表上的原子数。铂原子数乘其原子截面积即得的表面积。
(2)氯氧滴定法
氧氧滴定法是将Pt/Al2O3的化剂在温下先吸附氧,然局再吸附氢。氢和吸附的氧化合生成水,生成的水被吸收。由消耗的氢量,进而依O/Pt=1算出的表面积。有人认为此法得结果的精确度比H2或O2的化学吸附法都高。
也有人发现,H2和O2在Pt/Al2O3化剂上的化学吸附,H/Pt和O/P之比大于1。这大概是由于在高温下氢在铂微晶中发生溶解,或当Pt的浓度很小时氢的化学吸附机理改变,或气体也被载体吸附所致。
2.载体上银的表面积的测定
乙烯氧化为环氧乙烷的银催化剂,常用化確、刚玉等为体。实验发现,在150~300℃时氧与银能发生化学吸附。在实的温度范围内,载体对氧是情性的。因此应用氧的化学吸附可定银在载体表面上占的面积。
实验时先用氮低温物理吸附法测定银化剂的总表面积,后在200℃和1~1,5毫米柱压力下测定氧的饱和的化学吸附量,测得的数据列于表3-5。从氧的饱和的化学吸附量,可根据O/Ag=1算出银在载体上占据的面积。
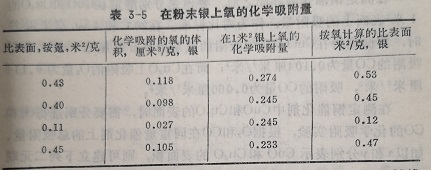
表中第一列和最后的一列分别为用测定的和用氧的化学吸附测定的银的比表面之值。由表中的数据可知,在银上氧的吸附量与表面积成正比,并且在1米银的表面上吸附氧的体积平均值为0.25厘米,此值与银表面上单分子层覆盖1米时需要的氧量0,22厘米³接近。
.jpg)
为了计算表面积,需要知道银原子的有效表面积。由X-射线结构分析数据得知,金属银晶体为棱边长4.08Å的面心立方晶格结构,这种结构的为图3-39所示。由图可知,一个银原子的有效截面积应当等于,
(4.08)²÷(1+4×0.25)=8,32Å
1米²银表面上应有1/8.32×10^-20=1.2×10^19个氧原子,或0.6×10^19个氧分子。此值在标准状况下占有的体积为0.6×10^19/2.687×10^19=0.22(厘米³)。
这就证明了用氧的化学吸附法可以测定银的表面积。例如用这种方法测定的载在刚玉和瓷质载体上银的
表面积,分别为10.2米³克和1.1米³/克。
3.氧化铜和氧化亚铜表面积的测定
测定组成复杂的催化剂的不同表面,需要根据催化剂的性质选择特殊的方法。在用于氧化反应的铜催化剂中,氧化铜和氧化亚铜处于随外部条件而变化的动态平衡。测定CuO-Cu2O体系的基础,是根据这两个组份对氧和一氧化碳具有不同的化学吸附能力。即CuO与CO,Cu2O与O2发生化学吸附。
在测定铜催化剂样品之前,要预先分别测定在CuO和CuO的1米2表面上的吸附量,作为对比标准。在20℃和4~6毫米汞柱时,实验测得在CuO上化学吸附的氧量为0.030厘米³/米²,化学吸附的CO量为0.104米³/米²而在Cu2O上吸附的O2量为0.114米³/米²,吸附的CO量为0.060米³/米²。
在测定铜催化剂中CuO和Cu2O的表面时,需要分别进行O2和CO的化学吸附实验,根据O2和CO在同重量催化剂上的总吸附量如以x和y分别表示CuO和Cu2O的表面积,则可建立下列二元联立方程式:
G.png)
式中Vo2,Vco分别为在同重量催化剂上吸附的O2和CO的体积(厘米³/克)。解方程式得
x= (1.190Vco-Vo2)/0.167
y=(3.47Vo2-Vco)/0.331
由此即可求得在复杂的铜催化剂中CuO和CuO分别占的表面积。
四、催化剂孔结构的测定
催化剂常用的物性指标有密度、孔容积、孔隙率、平均孔半径和孔径分布。
1.密度
催化剂的密度通常是以单位体积内含有的催化剂的重量表示。即
由于体积包含的内容不同,所以化剂的密度也有不同的表示内容。通常可分为堆密度、颗粒密度和真密度。
(1)堆密度
当用量筒测量化剂的体积时,所得到的密度称为堆积密度成堆密度,这时测量的体积中,包括三都分即颗粒与颗粒之间的空隙V隙、颗粒内部孔占的空间V孔和催化剂骨架所占的体积V真。即
V堆=V隙+V孔+V真
由此得化剂的堆密度
ρ堆=W/V堆=W/V隙+V孔+V真
式中W为称取的催化剂重量。堆密度的测量方法简单,即将催化剂放入量筒内,使量筒振动至体积不变后,记下体积,然后称重。当催化剂的颗粒较大时,量的直径不能过小,以免被测体积受到影响
(2)颗粒密度
在测量时扣除化剂颗粒与颗粒之的体积V。求得的密度,称为颗粒密度。
ρ颗=W/V孔+V真
在测量颗粒密度时,通常用汞在常压下只能进入孔半径大于50000Å的孔的原理测量颗粒之间的空隙V隙。测量时先将催化剂放入特制的已知容积的瓶中,再加汞,保持恒温,然后倒出汞,秤其重量,即可算出Va+Va的体积。用这种方法得到的密度,也叫做汞置换密度。
(3)真密度
当测量的体积仅仅是化剂颗粒骨架的体积时,测得的密度称为真密度。
ρ真=W/V真
测定V的方法和用测量颗粒之间的空隙V的方法相似。只是用氦不用汞。因为氮分子小,可以认为能进入颗粒内的所有细孔,以求得V隙+V孔。这样得到的密度,又叫做置换密度为了实用的目的,常常用某些溶剂例如苯代替氮。这样求得的密度就叫做苯置换密度。由于苯分子大于気分子,所以苯分子不能进入比它还小的细孔。所以苯置换密度稍小于真密度。但两者通常是非常接近的。
由以上所述可知,三种密度有如下系
ρ堆<ρ颗<ρ真
2.比孔容积、孔隙率和平均孔半径
(1)比孔容积
1克催化剂颗粒内所有孔的体积总和,称为比孔容积,或称比孔容。根据这个定义,比孔容可由上述方法测得的颗粒密度与真密度按下式算得式中1/ρ颗表示1克催化剂的骨架和颗粒内孔所占的体积,1/ρ真表示1克催化剂中骨架的体积。
催化剂的孔容积常用四氯化碳法测定。该法是在一定的四化碳蒸气压力下,利用四氯化碳将孔充满并在孔中凝聚,凝聚了的四氯化碳的体积,就等于催化剂内孔的体积。
发生凝聚现象的蒸汽压力P/P0。与孔半径的关系由开尔文方程式算出:
P6.png)
式中
σ一表示张力;V一克分子体积;ψ一接触角;P和Ps一实验时的蒸汽压力和实验温度下的饱和蒸汽压力。对于四氯化碳,在25℃时,σ=26.1达因/厘米;V=197厘米³/克分子;ψ=0°。
按上式计算的与P/P0值的关系列于表3-6。
.jpg)
测定时,将P/P0。调节到0.95。因为当相对压力大于0.95时,四氯化碳不但能在孔径更大的孔中凝聚,也能在颗粒之间凝聚这就使测量结果偏高。由表中数据可知,当相对压力为0.95时,测量的最大孔径为400。为了得到相对压力0.95的条件,可在四氯化碳中加十六烷,使溶液中含有131%体积的十六烷。若以,表示催化剂样品的重量,2表示催化剂的孔充满四氯化碳后的重量,以表示四氯化碳的密度,则比孔容可按下式计算
V比(毫升/克)=(W2-W1)/W1d
(2)孔隙率
催化剂颗粒中孔的体积,占催化剂颗粒体积(不包括颗粒之间的空隙)的分数,叫做孔隙率()。孔隙率可由下式计算
θ=(1/ρ颗-1/ρ真)/1/ρ颗
式中1/表示1克颗粒的体积1/ρ真表示1克颗粒的骨架体积,分子表示1克颗粒中孔的体积。
由 V孔容=1/ρ颗-1/ρ真
可得
θ=V孔容ρ颗
(3)平均孔半径
实际催化剂颗粒中孔的结构是复杂的和无序的。孔具有各种不同的形状、半径和长度。为了计算方便,将结构简化,以求均孔半径。
设每一颗粒的外表面积为Sx,每单位外表面上的孔口数为np则每个颗粒外表面上总口数为npSx。又设孔径和孔长都一样,以r表示平均孔半径,γ表示平均孔长,则一个孔壁的面积为2πrγ。而一个粒的内表面积应当等于npSx2πrγ。另方面,从实验测量的比表面Sg、每个颗粒的体积Vp和颗粒密度ρ颗,可得个粒的表面积为VPρpSg。若不计颗粒的外表面积,则得
npSx2πrγ=VPρpSg
用相似方法,可得一个颗粒的孔体积的计算值与测量值的等式:
npSxπr²γ=VPρpVg
式中Vg为比孔容。上式除以下式得平均孔半径的计算公式
r=2Vg/Sg
在实际工作中,常用测得的比孔容Vg和比表面Sg值计算催化剂的平均孔半径r。
3.孔隙分布
孔隙分布是催化剂的孔容积随孔径的变化。孔隙分布也和催化剂其他宏观物理性质一样,决定于组成催化剂物质的固有性质和催化剂的制备方法。当组成催化剂的物质已经确定后,制备方法就是决定的因素。
通常将催化剂颗粒中的孔按孔径大小分为三部分,孔半径小于100Å为细孔(或微孔),100~2000Å为过渡孔,大于2000Å为大孔(或粗孔)。这样的分法,完全是人为的。也有人分为两部分,小于100Å为细孔,大于100Å为粗孔。
测定孔隙分布的方法很多,孔径范围不同,可以选用不同的测定方法。大孔可用光学显微镜直接观察和用压汞法测定孔可用气体吸附法。这里仅介绍气体吸附法和压汞法。
(1)气体吸附法
气体吸附法测定孔隙分布是基于毛细管凝聚现象。根据毛细管凝聚理论,气体可以在其压力甚小于饱和蒸汽压下于毛细管中凝聚。若以P表示气体在半径为r的圆柱形孔中发生凝聚的压力,Ps表示气体在凝聚温度时的饱和蒸汽压力,则可推得描述毛细管凝聚现象的开尔文公式:
RE30HZW2.png)
式中 σ——用作吸附质的液体的表面张力;
V——在温度T下吸附质的克分子体积;
Ps——在温度下吸附质的正常的饱和蒸汽压力
P——在温度T下吸附质吸附平衡时的蒸汽压力。
由上式可见,孔半径越小,气体发生凝聚所需的压力P也越低。当蒸汽压力由小增大时,则由于凝聚被液体充填的孔径也由小增大,这样一直到蒸汽压力达到在该温度下的饱和蒸汽压力时,蒸汽可以在孔外,即颗粒外表面上凝聚,这时颗粒中所有的孔已被吸附质充满。
在多孔催化剂上吸附等温线常常存在所谓滞后环。即吸附等温线和脱附等温线中有一段不重叠,形成一个环(图3-40)。在此区域内,在相等的压力下脱附时的吸附量总大于吸附时的吸附量。这种现象可以作如下解释,即吸附由孔壁的多分子层吸附和在孔中凝聚两种因素产生,而脱附则仅由毛细管凝聚所引起。这就是说吸附时首先发生多分子层吸附,只有当孔壁上的吸附层达到足够厚时才能发生凝聚现象,而脱附时则仅发生毛细管中的液面上蒸发。
因此,为了得到按孔径大小的孔容积的分布曲线,应当采用脱附曲线,而不用吸附曲线。
为了得到孔隙分布,只需实验测定在不同相对压力(P/Ps)下的吸附量,即吸附等温线,即可算出孔分布。
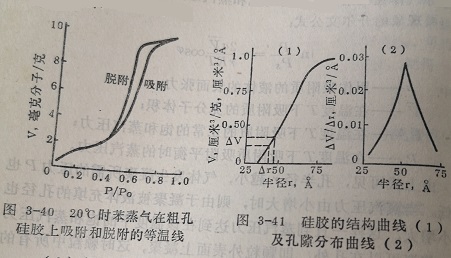
以粗孔胶的孔隙分布的测定为例,先用苯为吸附质,实验绘出(见图3-40)。根据开尔文公式由吸附等温线算出与相对蒸汽压力对应的孔半径,以孔半径对吸附量(体积以液体表示)作图,即得所谓结构曲线图3-41(1)。在结构曲线上用作图法求取当孔半径增加△r时液体吸附量的增加体积△V(即孔容积的增加值),然后以△V/对Δr作图,即得粗孔硅胶的孔隙分布曲线[图3-41-(2)。
(2)压汞法
汞不能使许多固体物质湿润,因此如果要使汞进入固体的孔中,必须施加外压。孔径越小,所需的外压也越大。压汞法就是利用这个原理,测量压入孔中汞的体积。
以σ表示汞的表面张力,汞与固体的接触角为ψ,汞进入半径为r的孔需要的压力为P,则孔截面上受到的压力为r²πP,而由表面张力产生的反方向张力为2πrσcosψ,当平衡时,二力相等,则
r²πp=-2πrcosψ
即
r=(-2σcosψ)/p
上式表示压力为P时,汞能进入孔内的最小半径。此式是压汞法的基础。
在常温下汞的表面张力σ为480达因/厘米²。接触角ψ,随固体有变化,但变化不大,对各种氧化物来说,约为140°。若压力P的单位为公斤/厘米²,孔半径r的单位为埃(Å),则上式可写成下式:
r(Å)=75000/P(公斤/厘米²)
由上式可以算得相对于P的孔径r的数值。
.jpg)
由此可见,要测量半径为7.5Å的孔隙,需要的压力为10000公斤/厘米²。现在已有定型的自动记录压汞仪,可测量半径大于10Å的孔隙。
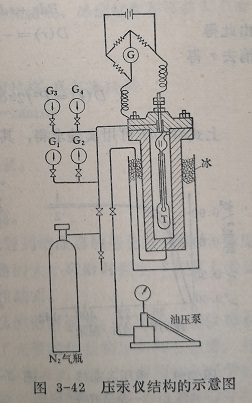
图3-42为压汞仪结构的示意图。仪器由三部分组成,即样品管、加压系统和电桥。图中为玻璃样品管管的上部为2~4毫米内径均匀的毛细管。管中有一根拉紧的丝,销丝的两端与电桥联接。加压系统由耐高压圆桶、N2气钢瓶、油压泵和压力表G1~G4组成。压力小于10公斤/厘米²时用N2气钢瓶,大与100公斤/厘米²时用压泵。电桥用于测量样品管中丝一求电阻的变化。
实验测定前,先将一定量催化剂装入样品管中,在特制的玻璃装置中加热,抽真空脱气,然后充汞。将充了汞的样品管进加压系统的时高压圆桶里,圆桶置于冰溶中,以保持恒温当测定开始后,汞随压力的增加不断进入催化剂颗粒的孔中,使玻璃毛细管中汞的液面不断下降,露出汞面的铂丝也不增长。因为汞实际上可以看做没有电阻的导体,所以丝电阻的增加可以作为汞面降低的量度,如果样品管内径均匀,即可求得孔隙随压力的变化。
计算方法如下。设半径介于r和r+dr之间的总孔容积为:
dV=D(r)dr
式中D(r)为孔径分布函数。若方程式Pr=-2σcosψ中的σ和ψ为常数,微分得
Pdr+rdP=0
D(r)=-P/r・dV/dP
由此得
消去r得
D(r)=P²/2σcosψ·dV/dP
上式dV/dP可用实验求得,其他各项都是已知的。亦即D(r)可以由实验求得
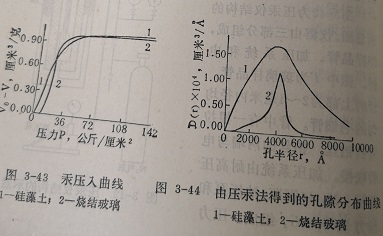
因为实验测定的孔容积是半径≥r的所有孔腺的容积,即总孔容积V0减去半径<r的孔容积。因此,dV/dP=-d(V0-_V)/dP 可从汞压入量与压力的关系曲线(图3-43)用图解微分法求得。即可求得D(r)、以D(r)对r作图即得孔分布曲(图3-44)。
