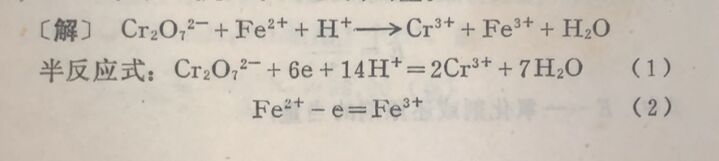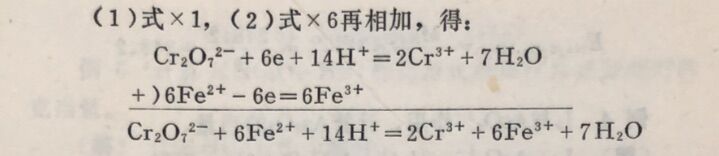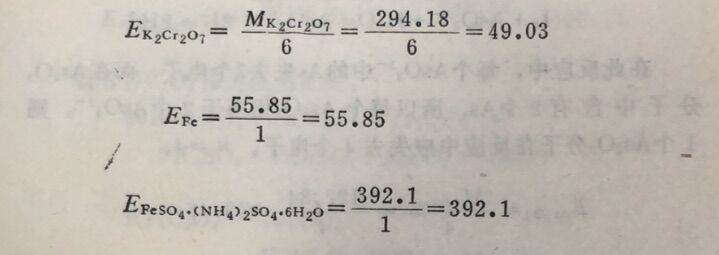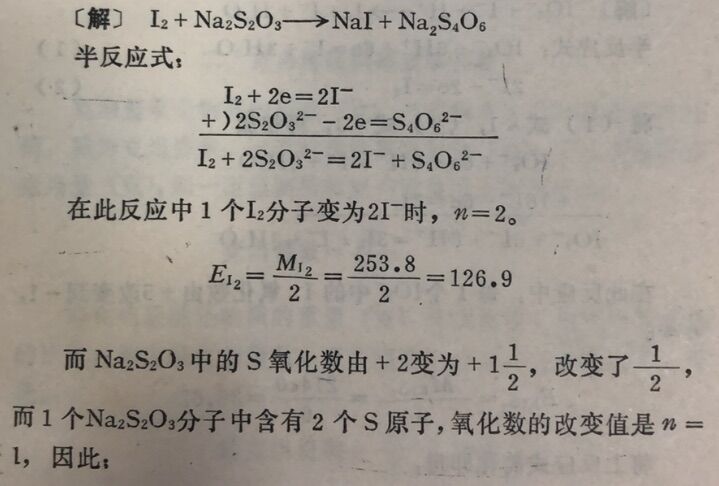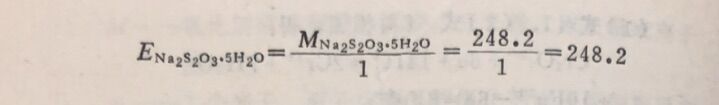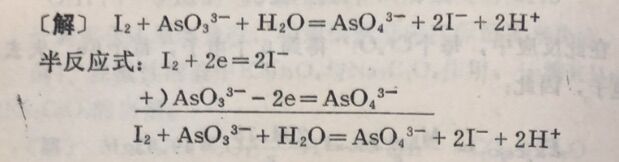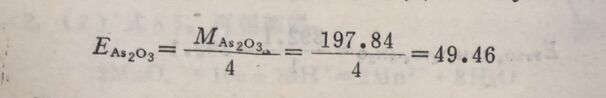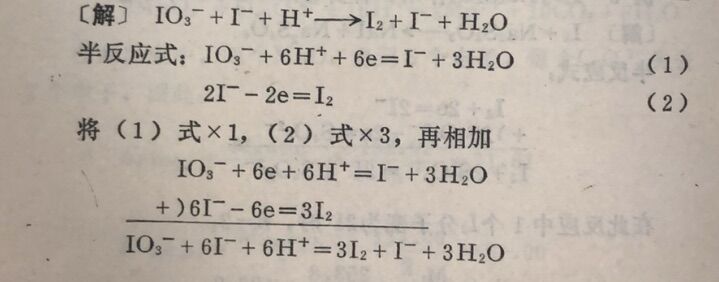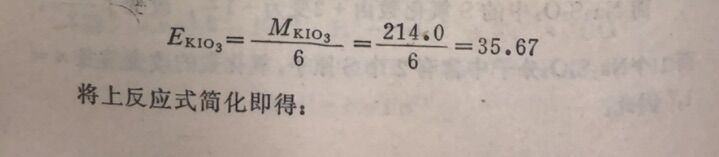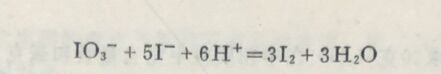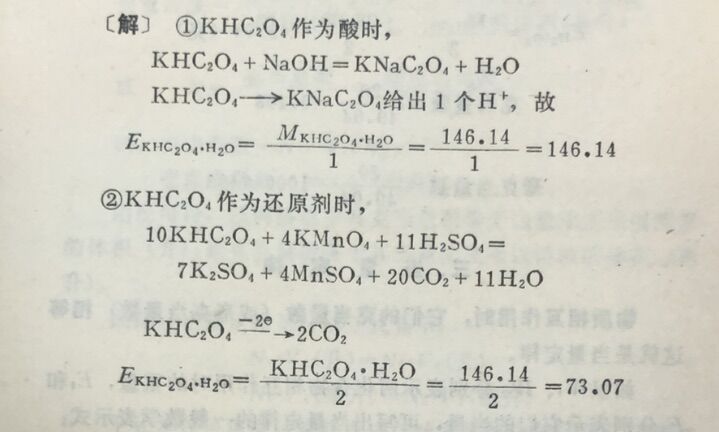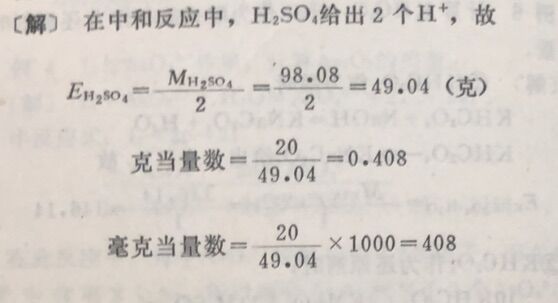M-氧化剂或还原剂的式量(分子量、原子量或离子量);
n-1个分子、原子或离子的氧化剂或还原剂在反应中转移的电子数或氧化数的改变值。
计算氧化还原当量时,必须根据反应实际情况来决定。
例1在酸性溶液中KMnO₄与Na₂C₂O₄作用,计算KMnO₄和Na₂C₂O₄的当量。
例2在酸性溶液中K₂Cr₂O₇与Fe²⁺作用,计算K₂Cr₂O₇, Fe, FeSO₄. (NH) ₂SO₄.6H₂O的当量。
在此反应中,每个Cr₂O₇²⁻得到6个电子,每个Fe²⁺失去1 个电子,因此:
例3 I₂与Na₂S₂O₃作用,计算I₂和Na₂S₂O₃的当量。
例4 I₂与AsO₃³⁻一作用,计算As₂O₃的当量。
在此反应中,每个AsO₃³⁻中的As失去2个电子,而在As₂O₃分子中含有2个As,所以每个As₂O₃相当于2个As₂O₃²⁻,则1个As₂O₃分子在反应中应失去4个电子,n=4。
例5在酸性溶液中,KIO₃与KI作用,计算KIO₃的当量。
在此反应中,每1个IO₃⁻中的I,氧化数由+ 5改变到-1, n =6
例6计算KHC₂O₄,+H₂O作为酸式盐和作为还原剂时的克当量。
二、克当量数和毫克当量数
克当量数是物质的重量(克) 与该物质1 克当量重量之比 值,称为克当量数。以W代表物质的重量(克), E代表物质的 克当量(克), 则一定量物质的克当量数可用下式表示:
克当量数=W/E
毫克当量数是物质的重量(克), 与该物质1毫克当量重量的比值,称为毫克当量数。克当量的千分之一为毫克当量。因此:
毫克当量数=W/E×1000
例求20克H₂SO₄在中和反应中克当量数和毫克当量数。


























![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)













.jpg)
.jpg)
.jpg)
.jpg)