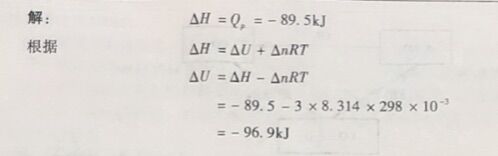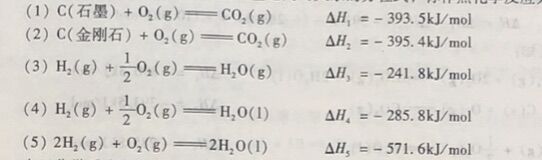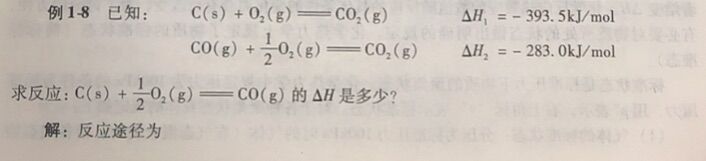化学反应的热效应
铜臭 / 2022-07-11
1.3 化学反应的热效应
化学反应中,不仅参加反应的物质发生了变化面且常常伴随有能量的改变。化学反应所释放的能量是日常生活和工业生产所需能量的主要来源。
1.3.1热效应与焓
化学反应伴随的能量变化形式虽有多种,但通常以热量形式表现出来,这就是热效应,又根据反应热。
根据反应过程恒容还是恒压,热效应又分为恒容热效应Qv,和恒压热效应Qp。
如果反应在恒容条件下进行,根据热力学第-定律,可得
ΔU=Qv+W
由于体积恒定(ΔV=0),没有非体积功,即W=0,则
ΔU=Qv
即在恒容条件下,热效应等于系统内能的变化。当ΔU>0时,Qv>0, 是吸热反应;当ΔU≤0时,Qv<0,是放热反应。
如果反应在恒压条件下进行,压力恒定,Δp=0, 系统对环境做体积功W= -pΔV。则
ΔU=Qp+W=Qp -pΔV
Qp=ΔU+pΔV
即恒压热效应等于系统的内能变化和体积功之和。
将pΔV=p(V₂- V₁)代人式(1-7)中得
Qp=(U₂-U₁) +p(V₂-V₁)
Qp=(U₂+pV₂) -(U₁ +pV₁)
热力学定义: H=U+pV
U, p和V都是状态函数,所以U+pV也是状态函数。H称为焓,是一个新的状态函数。H 的单位与热力学能的单位相同,单位为kJ/mol. ΔH为焓变,ΔH=H₂-H₁。这样式(1-8)变为
Qp=H₂-H₁=ΔH
即只做体积功的恒压热效应等于系统的焓变AH。由于U的绝对值不可求,因此焓的绝对值也不能确定。在实际应用中,涉及的都是焓变ΔH。
当ΔH>0时,Qp>0,是吸热反应:当ΔH<0时,Qp<0,是放热反应。
对于同一个化学反应来说,Qp和Qv的值并不相等,但是它们之间有一定的关系
Qv=ΔU
Q,p=ΔU +pΔV
两式当中,ΔU是相等的。所以
Qp=Qv+pΔV
如果化学反应中没有气体参加,只有液体和固体,那么体积的变化是很小的,也就是ΔV≈0,则pΔV可以忽略。那么式(1-10) 可以写成
Qp=Qv
如果化学反应中有气体参加,则体积的变化不可以忽略。恒压条件下,Δp=0。
pΔV= Δ(pV) = Δ(nRT) = ΔnRT
带人式(1-10), 得到
Qp =Qv + ΔnRT
ΔH =ΔU+ ΔnRT
例1-6下列反应中的Qp与Qv的值是否一致?
(1) C(s) +O₂(g)--=CO₂(g)
(2) CH₄(g) +2O₂(g) 一CO₂(g) +2H₂ao(I)
(3) 6CO₂(g) +6H₂O(I)一C₆H₁₂O₆(s) +60₂(g)
(4)Fe²⁺(aq) +Ag⁺(aq)一Fe³⁺(aq) + Ag(s)
解:根据Qp = Qv+ ΔnRT
(1)由于Δn=0,Qp= Qv;
(2)由于Δn≠0,Qp≠Qv;
(3)由于Δn=0,Qp=Qv;
(4) 由于没有气体参加反应,Qp=Qv。
例1-7 利用氯酸钾加热制取氧气的反应如下: 2K CIO₃(s) -2KCl(s) + 30₂(g)。298K时,加热2mol氨酸钾,放出89.5kJ热量。求298K时,该反应的ΔH和ΔU。
1.3.2热化学方程式
通常把能表示出化学反应与热效应之间的关系的方程式,称作热化学反应方程式。例如:
由于化学反应的热效应除与反应进行的条件(如温度、压力等)有关外,还与反应物、生成物的数量、状态等有关,因而在书写热化学反应方程式时应注意如下三点:
(1)注明物质的聚集状态。因为聚集状态不同,相应的能量也不同。一 般用g,I,s,表示气、液、固三种状态,用aq表示水溶液等,标注在该物质化学式的后面。此外如果一种固体物质可能有几种晶型,则应注明是哪种晶型。从方程式(1)和(2)可以看出注明物质晶型的必要性,从方程式(3)和(4)可以看出注明物质聚集状态的必要性。
(2) 注明反应的温度和压力。如果反应是在298.15K和100kPa下进行的,则按习惯可不注明。压力对热效应的影响不大。温度对化学反应的热效应有影响,但也不大。在本书中,可近似认为化学反应的热效应不随温度改变。
(3)正确写出配平的化学反应方程式。方程式中各物质前的计量系数表示物质的量,它可以是整数,也可以不是整数。同一反应,以不同的计量方程式表示时,其热效应数值是不同 的。从方程式(4)和(5) 可以看出注明化学计量数的必要性。
1.3.3盖斯定律
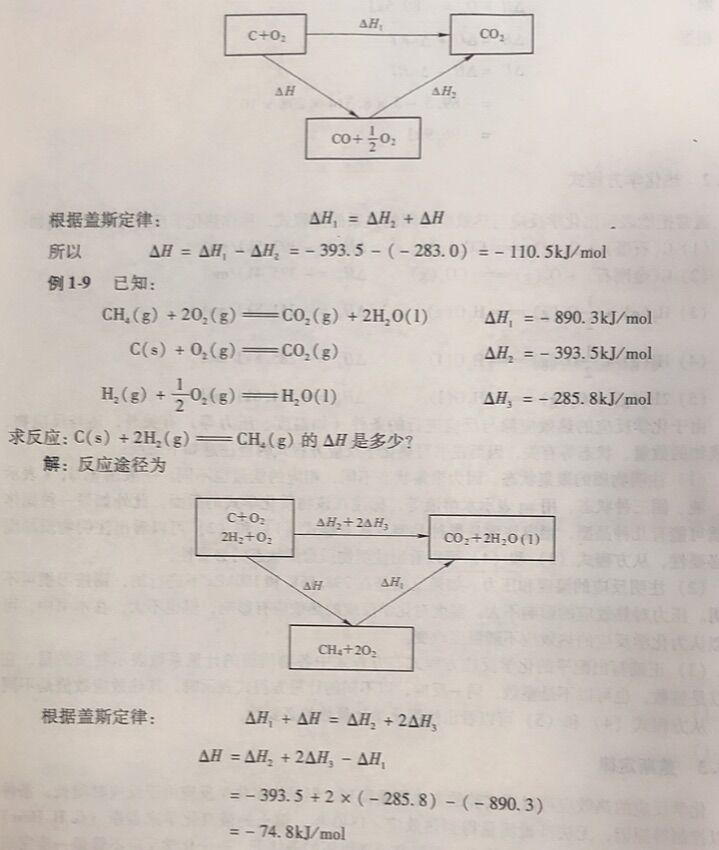
化学反应的热效应可以用实验的方法测量得到,但是许多化学反应由于反应时间长,条件 难以控制等原因,无法准确测量得到热效应。1840年, 瑞士的俄裔化学家盖斯(G. H.Hess在总结大量实验事实的基础上提出,在恒容或者恒压的条件下,一个化学反应不管是一一步完成的,还是多步完成的,其热效应总是相同的。这就是盖斯定律。盖斯定律是能量守恒定律的一 种特殊的表现形式。利用这-定律可以从已经精确测定的反 应的热效应来计算难于测量或不能测量的反应的热效应,可以从已知化学反应的热效应计算某些未知反应的热效应。


























![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)