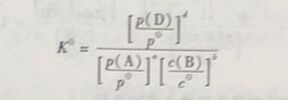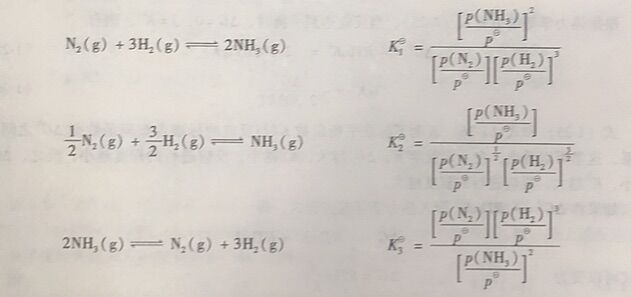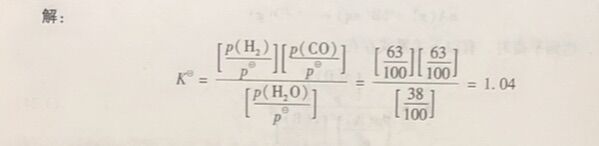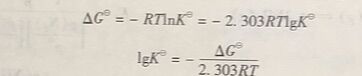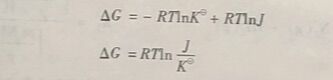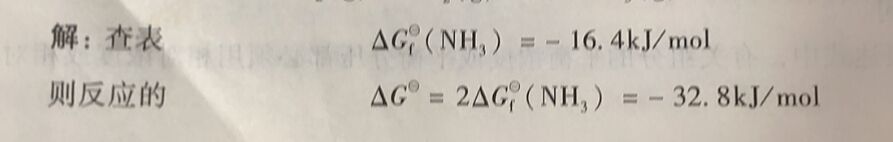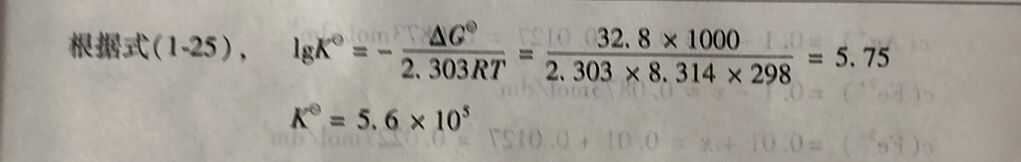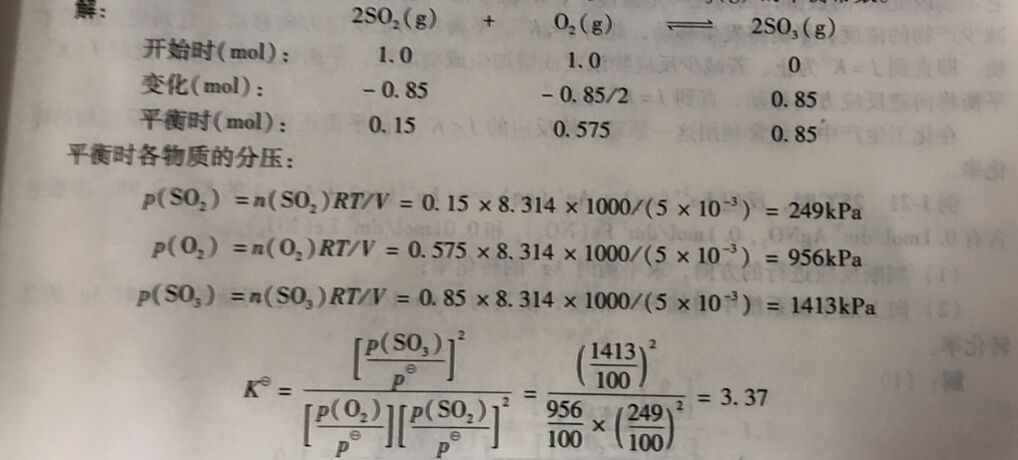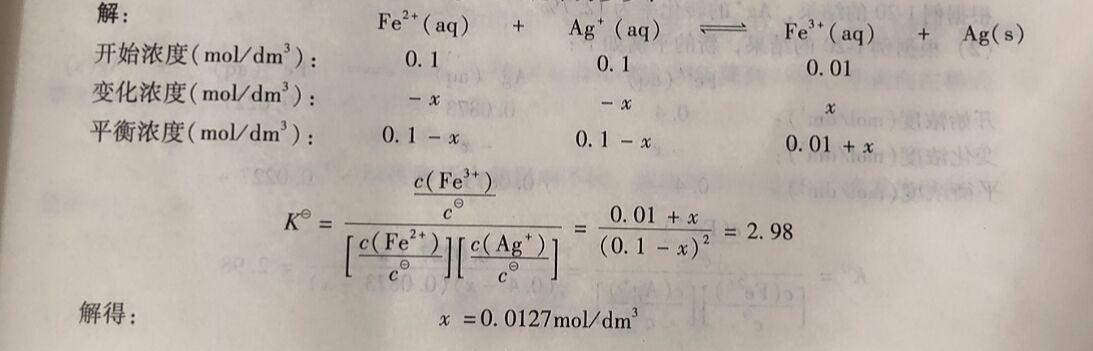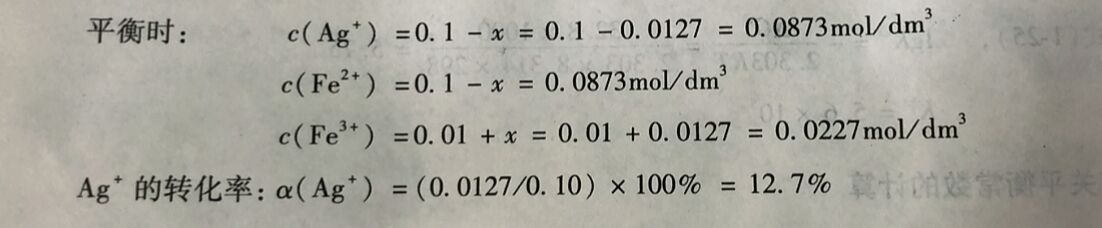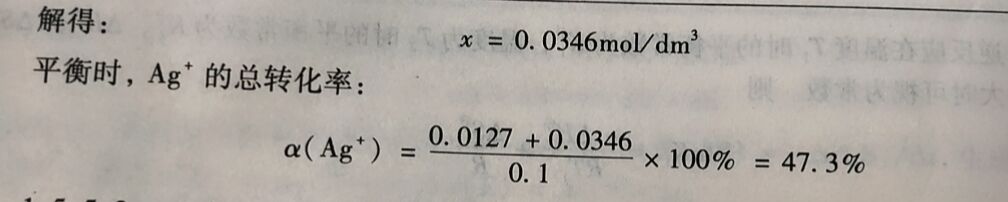化学平衡
铜臭 / 2022-07-11
对一个化学反应来说,不仅要考虑它在一-定条件下能否发生,而且还需知道该反应能进行到什么程度,即化学平衡问题。理论上:研究化学反应能达到的最大限度及有关平衡的规律性,具有重要意义。
1.5.1可逆反应 与化学平衡
在给定条件下,有些化学反应可以进行到底,有些化学反应只能进行到一定程度。我们把既可以正方向进行又能逆方向进行的化学反应称作可逆反应。
一般来说,所有的化学反应都有可逆性,只是可逆的程度有很大差别。由于正逆反应处于同一系统内,在密闭容器中,可逆反应不能进行到底,即反应物不能全部转化为生成物。
例如,在密闭容器内,装人氢气和碘气的混合气体,在一-定温度下生成碘化氢
H₂(g) +I₂(g)↹2HI(g)
在相同条件下,碘化氢又分解产生氢气和碘蒸气。在某一时刻,容器中H₂、I₂ 和HI三种气体同时存在。一般常把反应式从左到右进行的反应称作正反应,从右向左进行的反应称作逆反应。当该反应的正反应速率与逆反应速率相等时,系统所处的状态称为化学平衡。
化学平衡特征如下:
(1)反应的正反应速率与逆反应速率相等;
(2)反应物和生成物的浓度不再随时间面改变,此时,相应的反应物和生成物的浓度称为平衡浓度;
(3)反应物和生成物必须同处一处, 两者不能分;
(4)可以从正,反两个方向达到平衡。
从表面上看,化学反应达平衡以后,反应似乎已停止,但实际上正逆反应仍然进行,只是 正,逆反应速率相等。因此,化学平衡是- 个动态平衡。
1.5.2标准平衡常数
为了更好地研究化学平衡,必须找出平衡时反应系统内各组分之间的关系。平衡常数就可以作为衡量平衡状态的标志。对于如下可逆化学反应
aA(g)+bB(ap)↹dD(g)
在一定温度下,达到平衡时,有以下关系式存在
式中,K为标准平衡常数。标准平衡常数的表达式中各物种均以各自的标准态为参考态,若某物质是气体,则以相对分压来表示;若是溶液中的某溶质,则以相对依度来表示。这里p(D)、p(A)分别是达到化学平衡时物质D和A的平衡分压,c(B)是化学平衡时物质B的平衡浓度。将p(D)、p(A)除以p得到相对分压,将c(B)除以c得到相对浓度。固体或统液体不出现在K表达式中。
平衡常数的表达式及其数值与化学反应方程式的写法有关,例如:
由上面的式子可以看出,方程式的系数增大n倍,反应的平衡常数K将变成(K)ⁿ;正反应的平衡常数与逆反应的平衡常数互为倒数。
关于标准平衡常数K有如下几点说明:
(1) K是无量纲的量。
(2)标准平衡常数表达式必须与化学反应计量式相对应。同一化学反应以不同的计量式表示时,其K的数值不同。
(3) 标准平衡常数表达式中,有关组分的平衡依度或平街分压都必须用相对浓度或相对分压来表示。
(4) K表达式中各物质的相对浓度或相对分压必须是平衡时的相对浓度或相对分压。
(5)标准平衡常数K与系统的浓度无关,仅是温度的函数。一定温度下,标准平衡常数K数值越大,说明反应正向进行的程度越大。
(6)如果某一反应可表示为两个或多个反应的和或差,则该反应的平衡常数等于两个或多个反应的各平衡常数的乘积或商。
例1-17实验室常用以下反应制备水煤气C(s) +H₂O(g)=H₂(g) + CO(g),在1000K下达到化学平衡,平衡分压分别为p(H₂) =p(CO) =63kPa,p(H₂O) = 38kPa,求标准平衡常数K。
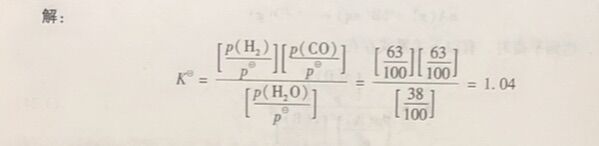
1.5.3标准 吉布斯函数和标准平衡常数之间的关系
化学反应达到平衡以后,各物质的组成不再变化。因此,在平衡状态下测定各物质的平衡 组成就可以确定这反应的标准平衡常数。 此外,还可以利用反应的标准吉布斯函数变ΔG与标准平衡常数K之间的关系式来计算该反应的标准平衡常数。
对任一化学反应
aA +bB↹dD+eE
根据热力学等温方程式(1-23),当反应达到平衡时,ΔG=0, J=K,则有
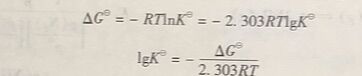
式(125) 和式(1-26)表明了标准平衡常数K与反应的标准吉布斯函数变ΔG之间的关系。这里可以看出,在一定温度下,。ΔG越大,K越小,反应进行的程度越小:反之,ΔG越小,K越大,反应进行的程度越大。
如果将ΔG =-RTnK带人热力学等温方程式,得
上式可变为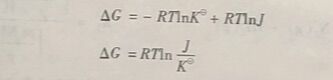
这里,可以将上式与化学反应方向的判据联系在一起:
当J<K时,反应自发进行。
当J=K时,反应达到平衡。
当J>K时,反应逆向自发进行。
例1-18计算反应N₂(g)+3H₂(g)⇔2NH₃(g)在298K时的标准平衡常数K。
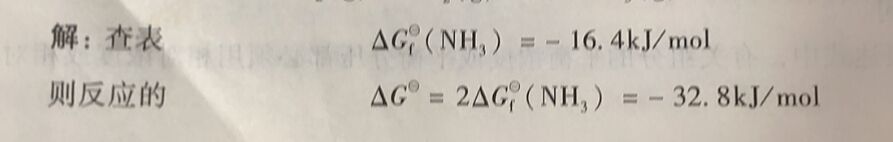
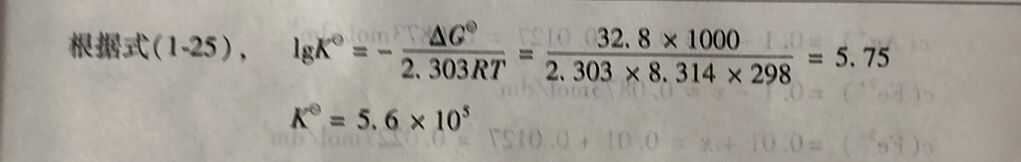
1.5.4有关平衡常 数的计算
根据平衡常数的大小可以衡量反应进行的程度,利用平衡常数也可以进行一些计算。例如,计算平衡时反应物或产物的浓度,求反应物的转化率。某反应的转化率是指平衡时该反应物已转化的量占起始量的百分率,通常用α表示,即

关于平衡常数、平衡浓度、转化率的计算一般按照以下过程处理: 写出配平的化学反应方程式;表示出起始浓度和平衡浓度:确定未知数;列出平衡常数的表达式,将各物质的平衡浓度带入计算;列方程解出未知数。
例1-19 1000K 时向容积为5.0dm³的密闭容器中充人1. 0mol O₂和1.0mol SO₂气体,平衡时生成了0.85mol SO₃气体。计算反应2SO₂(g) +O₂(g) ⇔2SO₃(g)的平衡常数。
例1-20 25°C时, 反应Fe²⁺(ag) +Ag⁺(ag)⇔Fe³⁺(aq) +Ag(s)的K =2.98。当溶液 中含有0. 1mol/dm²AgNO₃,0. 1mol/dm³ Fe( NO₃)₂和0. 01mol/dm³Fe(NO₃)₃时,按上述反应进 行,求平衡时各组分的浓度为多少? Ag⁺的转化率为多少?
1.5.5化学平衡的移动
一切平衡都是相对的,暂时的。 化学平衡也是相对的,暂时的,有条件的。当外界条件改 变时,平衡就被破坏。在新的条件下,反应将向某一方向移动 直到建立起新的平衡。这种因外界条件改变而使化学反应由原来的平衡状态改变为新的平衡状态的过程叫做平衡的移动。这里所说的外界条件主要指浓度、压力和温度。
改变平衡状态的条件,平衡向着减弱这种改变的方向移动,直到建立起新的平衡为止。此即化学平衡移动原理,亦称吕.在德里平衡移动原理。
1.5.5.1浓度对平衡移动的影响
根据反应商J的大小,可以推断化学平衡移动的方向。浓度虽然可以使平衡发生移动,但 它不能改变K的数值,因为在一定温度下, K值一定。当温度一定时, 增加反应物的浓度或 减少产物的浓度,平衡将发生移动,此时J<K。平衡将向正反应方向移动,直到建立新的平衡,即直到J=K为止。若或少反应物浓度或增加生成物浓度,平衡也发生移动,此时J>K,平衡将向逆反应方向移动,直到J=K为止。
在化工生产中,经常利用这一原理, 使反应的J<K°,使平衡正向移动来提高反应物的转化率
例1-21 25°C时,反应Fe²⁺(aq) +Ag⁺ (aq)⇔Fe³⁺(aq) +Ag(s)的K =2.98。溶液中 含有0.1mol/dm³ AgNO₃ 0.1mol/dm³ Fe( NO₃)₂和0.01mol/dm³Fe( NO₃)₃。
(1)判断反应进行的方向,求平衡时Ag的转化率;
(2)向上述平衡系统中增加Fe²⁺浓度,使其为0.4mol/dm³,求达到新的平衡时Ag⁺的总转化率.