原电池及其组成
铜臭 / 2022-07-12
3.2.1原电池
化学反应总是伴随着能量的变化(ΔH、ΔG)。 依照利用途径的不同,化学反应释放的能量可以转变为不同的能量形式。25°C时,天然气与氧的完全氧化反应为
CH₄(g) + 2O₂(g)=CO₂(g) + 2H₂O(l)
ΔH=-890.8kJ/mol, ΔG =-818.4kJ/mol
燃气炉灶是用天然气与空气中的氧气燃烧,释放的热量用于加热,将化学能转化为热能;汽车发动机是先把化学能转化为热能,再通过产生高压蒸汽推动活塞产生动能;而火力发电厂 则是将动能进一步转化为电能。 由于燃烧反应是快速反应,所以燃烧产生的大量热传给了环 境。而且每一转化过程都有一定的效率, 转化的步骤越多,总的效率越低。内燃机的效率一般不超过20%。
若把化学能直接转变为电能,效率就高得多。研究化学能与电能之间转化规律的科学称为电化学。使化学能直接转变为电能的装置称为原电池。
任何自发的氧化还原反应均为电子从还原剂转移到氧化剂的过程。把锌放在硫酸铜溶液中,锌溶解而铜析出
Zn(s) + CuSO₄(aq)=Cu(s) + ZnSO₄(aq)
反应的实质是Zn原子失去电子,被氧化成Zn²⁺;
Cu²⁺得到电子,被还原成Cu原子。由于锌和硫酸铜溶液直接接触,电子就从Zn原子直接转移给Cu²⁺,因而得不到有序的电子流。随着氧化还原反应的进行,溶液温度将升高,即反应中放出的化学能转变为热能。
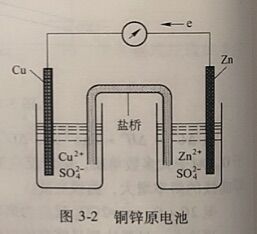
在图3-2装置中,氧化和还原反应分别在两个烧杯中进行。在一个烧杯中放人ZnSO₄溶液和锌片,在另一个烧杯中放人CuSO₄溶液和铜片,用盐桥(饱和KCI溶液的琼脂胶冻)将两个烧杯中的溶液联系起来。当接通外电路时,有电流通过。
理论上,任何一个自发进行的氧化还原反应都可以组成原电池。但由于反应速率、安全性和技术条件等因素的限制,原电池可以利用的氧化还原反应仅是极少数。安全、高效的原电池一直是世界各国化学电源研究开发的热点。
原电池可用电池符号表示。书写电池符号时,习惯上把电池的负极写在左边,正极写在右边,以“Ι”表示相界面,以“‖”表示盐桥。一般需要标明反应物质的浓度或压力。若反应物中没有电子导体,须外加惰性电极(如石墨、铂),惰性电极仅起导电作用,不参加电极反应。原电池符号的书写方式为
3.2.2电极
3.2.2.1电极和半电池
在电池中,把电子流出的一极称为负极, 电子流人的一极称为正极。即发生氧化反应的电极为负极,发生还原反应的电极为正极。因此,在上述铜锌原电池中,锌片为负极,铜片为正 极。两极上的反应称为电极反应。又因每-电极是原电池的一 半, 又称为半电池反应。铜锌原电池中的电极反应和电池反应为
负极反应 Zn(s)=Zn²⁺(aq) +2e
正极反应 Cu²⁺(aq) +2e===Cu(s)
电池反应 Zn(s) +Cu²⁺(aq)==Zn²⁺(aq) + Cu(s)
电极必须包含两类物质,一类是还原型物质, 另一类是相应的氧化型物质。电极中氧化型物质和还原型物质之间存在如下关系
氧化型+ne⇔还原型
或写为 Ox+ne⇔Red
3.2.2.2电对
氧化型物质与还原型物质组成氧化还原电对,简称电对,以“氧化型/还原型”来表示。例如,在铜锌原电池中,铜电极的电对为Cu²⁺/Cu,锌电极的电对为Zn²⁺/Zn
不仅金属和它的离子可以构成电对,而且同一种金属的不同价态离子 、非金属单质及其离子、金属及其难溶盐等都可以构成电对,例如Fe³⁺/Fe²⁺,MnO₄⁻/Mn²⁺, H⁺/H,₂,Cl₂/CI⁻,AgCl/Ag等。