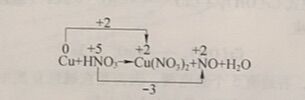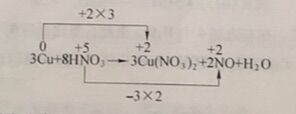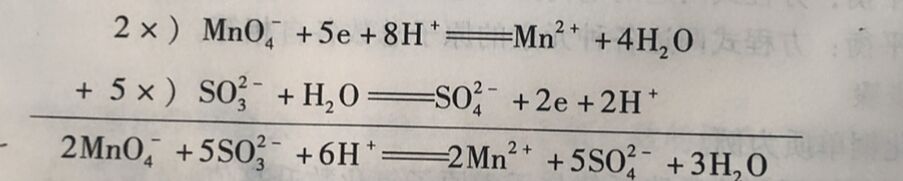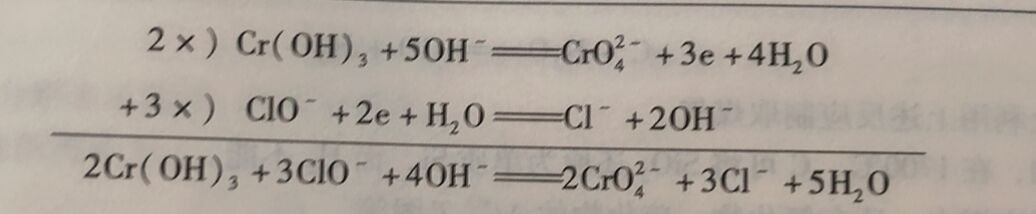氧化还原反应
铜臭 / 2022-07-12
3.1.1氧化数
1970年国际纯粹和应用化学联合会(IUPAC) 定义了氧化数的概念:氧化数是指某元素的 个原子的荷电数。该荷电数是假定把每一 化学键的电子指定给电负性更大的原子而求得的。即氧化数的数值取决于两个成键原子电负性的相对大小,电负性小的氧化数为正值,电负性大的氧化数为负值。确定氧化数的规则如下:
(1)在单质中,元素的氧化数为0。
(2) 在简单离子中,元素的氧化数等于离子所带的电荷数。如FeCl₂、 Fe₂O₃、 Fe₃O₄中Fe 的氧化数分别为+2、+3、 +8/3
(3) 在多原子离子中,各元素氧化数的代数和等于离子所带电荷数。
(4)在大多数化合物中,氢的氧化数为+1;只有在金属氢化物( 如NaH、CaH₂)中,氢的氧化数为-1。
(5) 通常,在化合物中氧的氧化数为-2;但是在H₂O₂、Na₂O₂、 BaO₂等过氧化物中氧的氧化数为-1;在氧的氟化物中,如OF₂和O₂F₂中,氧的氧化数分别为+2和+1。
(6) 在所有的氟化物中,氟的氧化数为-1。
(7)碱金属和碱土金属在化合物中的氧化数分别为+1和+2。
(8)在中性分子中,各元素氧化数的代数和为零。
例3-1 (1) 确定SO₄²⁻、 S₄O₆²⁻、S₂O₈²⁻、Na₂S₂O₃ 中S的氧化数。
(2) 确定CH₄、CH₃CI、 CH₂Cl₂、 CHCI₃中C的氧化数。
解: (1) SO₄²⁻、S₄O₆²⁻、 S₂O₈²⁻ 、Na₂S₂O₃中S的氧化数分别为+6、+2.5、+7、+2。
(2) CH₄、CH₃CI、CH₂Cl₂、CHCI₃中C的氧化数分别为-4、-2、0、+2。
3.1.2氧化还原反应
参加化学反应的各种物质在反应前后有电子得失,失去电子的过程称为氧化:得到电子的过程称为还原。氧化过程与还原过程同时发生,称作氧化还原反应。
氧化剂是得电子的物质,多是最高氧化态,如HNO₃中的N(+5);还原剂是失电子的物 质,多是最低氧化态,如NH₃中的N(-3)。中间氧化态者既可以是氧化剂,又可以是还原剂,如HNO₂中的N(+3)。
另外有一种情况, 某种单质或化合物, 它既是氧化剂又是还原剂,这类氧化还原反应称作歧化反应。例如
Cl₂+H₂O=HCIO+HCI
4KCIO₃=3KCIO₄+KCI
3.1.3氧化还原反应方程式的配平
3.1.3.1氧化数法
A配平原则
(1)得失电子平衡:反应中氧化剂所得到的电子数等于还原剂所失去的电子数。
(2)电荷平衡:方程式两边的电荷数(包括电子)的代数和相等。
(3)物质平衡:方程式两边各种元素的原子总数各自相等。
B配平步骤
以硝酸氧化铜单质为例。
(1)找出元素原子氧化数降低值与元素原子氧化数升高值
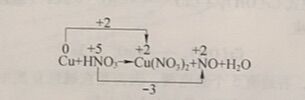
(2)得失电子数相等
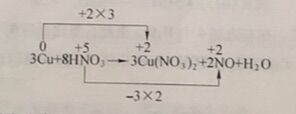
(3) 物质平衡。方程式左边有8个H,则在右边加4个H₂O。
3Cu + 8HNO₃=3Cu( NO₃)₂ + 2NO + 4H₂O
(4) 检验平衡。检查方程式两边各种原子数是否相等、电荷数是否相等。
3.1.3.2 离子-电子法
离子电子法也称为半反应法。氧化还原反应可以拆为两个半反应,即氧化剂的还原反应和还原剂的氧化反应。离子电子法是将两个半反应分别配平,再将两个半反应合为一个完整反应。
离子—电子法特别适用于水溶液中离子方程式的配平。
离子一电子法的配平原则与氧化数法的配平原则相同。
配平步骤如下(以酸性介质中反应MnO₄⁻+SO₃²⁻→+Mn²⁺ +SO₄²⁻为例) :
(1) 拆分出两个半反应,并根据氧化数变化写出得失电子
MnO₄⁻+5e→Mn²⁺
SO₃²⁻→SO₄²⁻+2e
(2)电荷平衡。 还原反应左边有6个负电荷,右边有2个正电荷,因为是在酸性介质中在方程式左边加8个H⁺,即8个正电荷。则还原反应方程式两边各有2个正电荷
MnO₄⁻+5e+8H⁺→Mn²⁺
氧化反应左边有2个负电荷,右边有4个负电荷,为保持电荷平衡,在右边加2个H⁺。
SO₃²⁻→SO₄²⁻+2e+2H⁺
(3)物质平衡。还原反应左边有8个H⁺,在右边加4个H₂O
MnO₄⁻+5e+8H⁺=Mn²⁺+4H₂O
氧化反应右边有2个H⁺,在左边加1个H₂O
SO₃²⁻+H₂O=SO₄²⁻+2e+2H⁺
(4)检验半反应。
(5)半反应相加,消去电子。将2个半反应乘以适当系数再相加,消去方程式两边的电子,得到配平的氧化还原反应方程式。
例3-2配平反应方程式 Cr(OH)₃+ CIO⁻→CrO₄²⁻+2Cl⁻(碱性介质)
解: (1)配平氧化反应
Cr(OH)₃→CrO₄²⁻+3e
方程式左边没有电荷,右边有5个负电荷。因为是在碱性介质中,在方程式左边加5个OH⁻,即5个负电荷。则反应方程式两边各有5个负电荷
Cr(OH)₃+5OH⁻→CrO₄²⁻+3e
方程式左边有8个H⁺,在右边加4个H₂O。至此,氧化反应配平
Cr(OH)₃+5OH⁻→CrO₄²⁻+3e+4H₂O
(2) 配平还原反应
ClO⁻+2e→Cl⁻
方程式左边有3 个负电荷,右边有1个负电荷。在方程式左边加2 个OH⁻。则反应方程式两边各有3个负电荷
ClO⁻+2e→Cl⁻+2OH⁻
方程式右边有2个H(在OH⁻中),在右边加1个H₂O。至此,还原反应配平
ClO⁻+2e+H₂O=Cl⁻+2OH⁻
将2个半反应乘以适当系数, 相加,消去方程式两边的电子,得到配平的氧化还原反应方程式。