前面我们讨论了分子内相邻原子之间的相互作用力-化学键, 化学键是决定分子性质的主要因素,但是单从化学键的角度,还不能说明物质的全部性质。如水的三态变化,从 g→l→s,表明除了化学键以外,分子和分子之间也存在作用力-分子间力。分子间力是决定物质的熔点、沸点、熔化热、汽化热、溶解度、表面张力、黏度等物理性质的主要因素。
| 物质 | 偶极矩μ/C·m |
分子空间构型 | 物质 | 偶极矩μ/C·m | 分子空间构型 |
| H₂ |
0 | 直线型 | H₂S |
3.07×10⁻³⁰ |
V字形 |
| CO | 0.33×10⁻³⁰ |
直线型 | H₂O |
6.24×10⁻³⁰ |
V字形 |
| HF | 6.40×10⁻³⁰ |
直线型 | SO₂ |
5.34×10⁻³⁰ |
V字形 |
| HCI | 3.62×10⁻³⁰ |
直线型 | NH₃ |
4.34×10⁻³⁰ |
三角锥形 |
| HBr | 2.60×10⁻³⁰ |
直线型 | BCI₃ |
0 | 平行三角形 |
| HI | 1.27×10⁻³⁰ |
直线型 | CH₄ |
0 | 正四面形 |
| CO₂ |
0 | 直线型 | CCI₄ |
0 | 正四面形 |
|
CS₂
|
0 | 直线型 | CHCl₃ |
3.37×10⁻³⁰ |
四面体 |
| HCN | 9.64×10⁻³⁰ |
直线型 | BF₃ |
0 | 平面三角形 |


| 分子 | 极化率/C·m²·V⁻¹ |
分子 | 极化率/C·m²·V⁻¹ |
| He | 0.227×10⁻⁴⁰ |
HCI | 2.85×10⁻⁴⁰ |
| Ne | 0.437×10⁻⁴⁰ |
HBr | 3.86×10⁻⁴⁰ |
| Ar | 1.81×10⁻⁴⁰ |
HI | 5.78×10⁻⁴⁰ |
| Kr | 2.73×10⁻⁴⁰ |
H₂O |
1.61×10⁻⁴⁰ |
| Xe | 4.45×10⁻⁴⁰ |
H₂S |
4.05×10⁻⁴⁰ |
| H₂ |
0.892×10⁻⁴⁰ |
CO |
2.14×10⁻⁴⁰ |
| O₂ |
1.74×10⁻⁴⁰ |
CO₂ |
2.87×10⁻⁴⁰ |
| Cl₂ |
5.01×10⁻⁴⁰ | CH₄ |
3.00×10⁻⁴⁰ |
| Br₂ |
7.15×10⁻⁴⁰ |
C₂H₆ |
4.81×10⁻⁴⁰ |
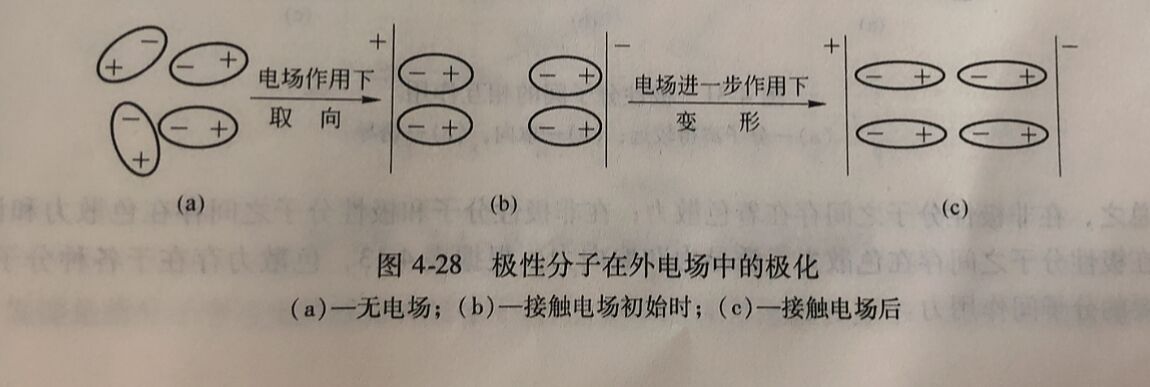
对于极性分子来说,本身就存在着偶极,这种偶极称为固有偶极或永久偶极。在外电场的 作用下,极性分子正极一端将转向负电极, 负极端转向正电极,见图4-28, 这一过程称作分 子的定向极化。而且在外电场的进一步作用下, 产生诱导偶极,分子的偶极为固有偶极和诱导偶极之和,分子的极性增强。