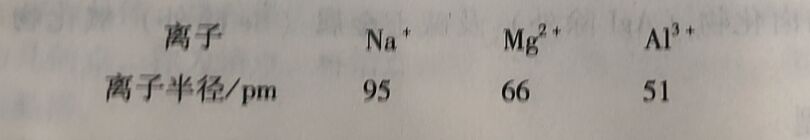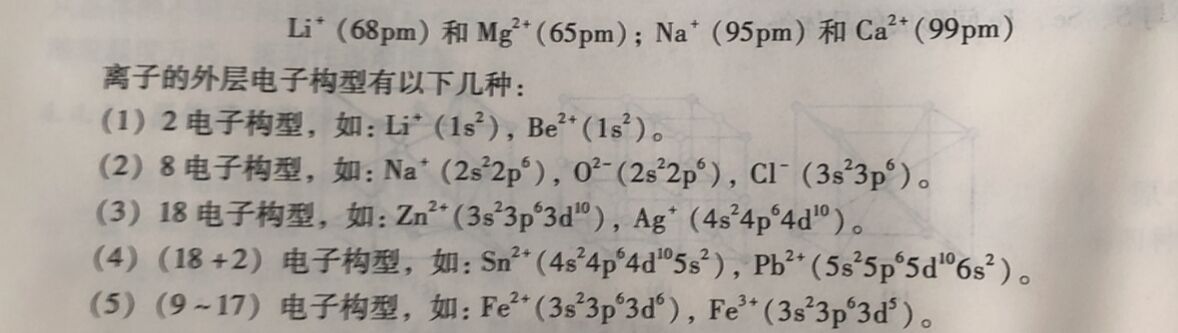例4-11 排列出Au、 CO₂、 HCl、HF品体熔点高低的顺序。
解: Au为金属晶体,离子间作用力为金属键:;CO₂为非极性分子,分子间作用力为很弱的色散力; HCl为强极性分子晶体,分子间作用有色散力、诱导力、取向力; HF 除具有HCI所 有作用力外,分子间还有强烈的氢键作用。所以,熔点高低顺序与微粒间作用力大小相一致: Au> HF > HCl>CO₂。
4.4.2离子晶体
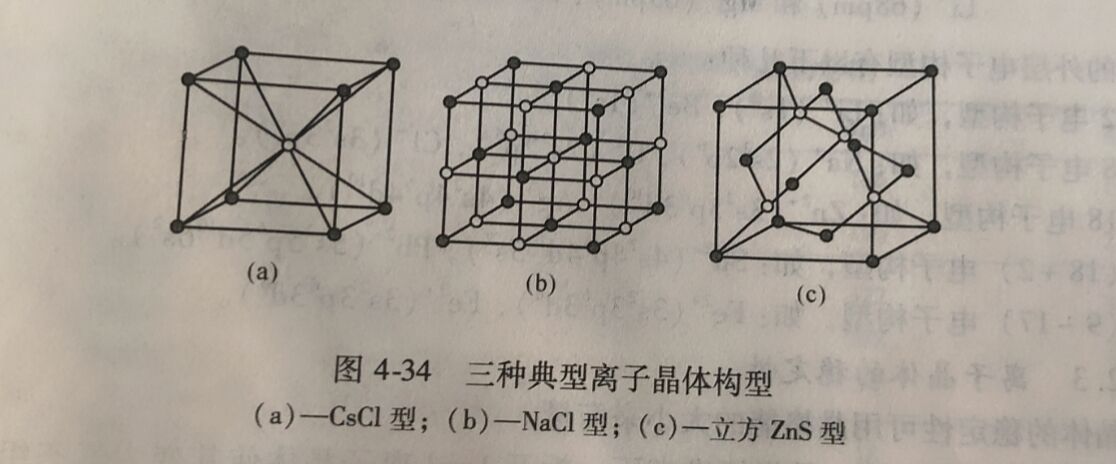
离子晶体中,晶格结点上有规则的交替排列着阴、阳离子。通常把晶体内,某一粒子周围 最接近的其他粒子的数目,称为该粒子的配位数。例如,NaCl 晶体中,每个Na⁺周围有6个 Cl⁻,每个Cl⁻周围有6个Na⁺,所以Na⁺和Cl⁻的配位数都是6。离子晶体中,阴、阳离子在空间的排列状况是多种多样的,下面主要介绍三种典型的结构类型。
4.4.2.1离子晶体的三种典型构型
A CsCl型
如图4-34 (a) 所示,负离子(CI⁻) 占据立方体的八个顶点,正离子(Cs⁺) 处于立方体 的体心。正、负离子的配位数比为8: 8。许多晶体如TICI、CsBr、CsI 都属于此类型。
B NaCl型
如图4-34 (b) 所示,负离子(CI⁻)以面心立方方式排列,正离子(Na⁺) 填充在负离子形成的全部八面体空院中,正、负离子的配位数比为6:6。许多晶体,如碱金属(Cs除 外)卤化物,Ag的卤化物(AgI 除外)及碱土金属(Be 除外)氧化物和硫化物等均属于NaCl型。
C 立方ZnS型
如图4-34 (c)所示,负离子(S²⁻) 以面心立方方式排列,正离子(Zn²⁺) 占据一半四 面体空院中。正、负离子的配位数比为4: 4。属于立方ZnS型的晶体有: Agl, BeO 以及Zn、Cd、Hg与S、Se、Te间形成的晶体等。
4.4.2.2 离子半径与离子的电子构型
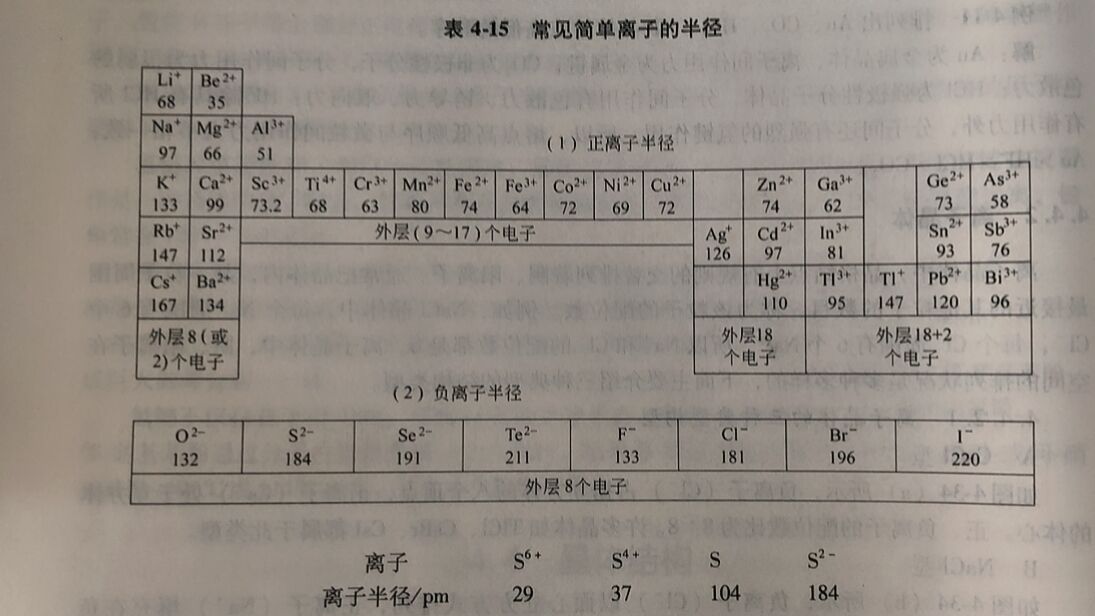
离子与原子类似,核外电子都是以几率的形式存在,所以很难确定离子的边界。我们把离子晶体中正、负离子的平衡核间距看作是正、负离子半径之和,它反映了离子在晶体中显现出来的大小。常见简单离子的半径大小见表4-15。
由表4-15可见,负离子的半径一般大于正离子半径。同一元素形成的不同离子,阴离子半径大于原子半径,阳离子半径小于其原子半径,且阳离子的电荷愈多,其半径愈小,例如:
同一周期,主族元素的离子半径随着族数的递增依次减小,如:
具有相同电荷数的同族离子,自上而下,半径逐渐增大。在周期表中位于相邻族左上方和右下方斜对角线上的元素离子半径相近,如: