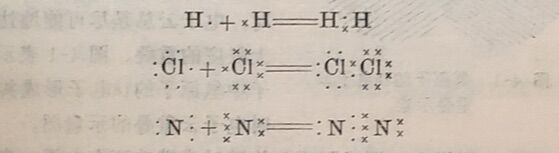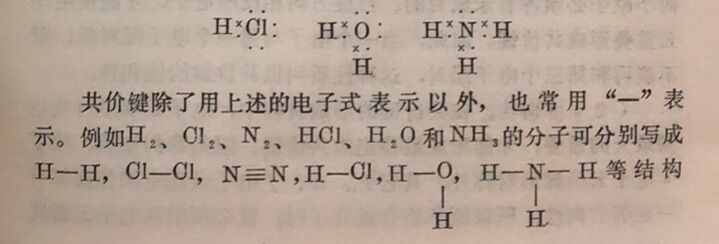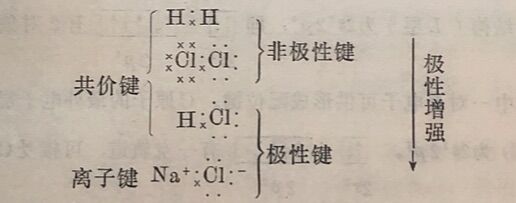如前所述,离子键没有方向性和饱和性。这是离子键区别于共价键的两个重要特征。
(3)类型。共价键是由原子间共用电子对形成的,根据共用电子对在原子间是否有偏移,又将共价键分为非极性键和极性键。
当相同元素的原子形成共价键时,例如Cl—Cl, O=O,N≡N等非金属单质分子,它们的共用电子对是均等地属于两个原子。也就是说,共用电子对在两个原子的中间,即共价键不显正、负极。这种不显正、负两极的共价键叫非极性键,如上述 Cl₂、O₂、 N₂等非金属单质分子中的共价键。
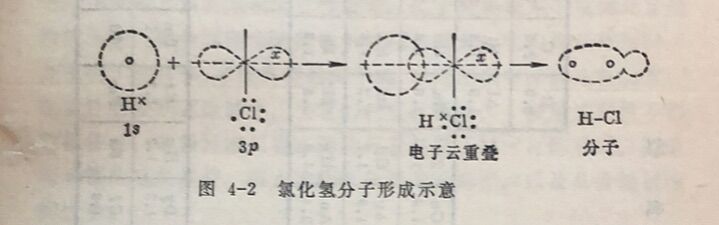
当不同元素的原子形成共价键时,由于两种原子吸引电子的能力不相同,因此共用电子对不是均等地属于两个原子,而是偏向于吸引电子能力较强的原子一边。例如在HCI分子中,共用电子对偏向于非金属性较强的CI原子一边,使共价键具有正、负极。这种具有正、负两极的共价键叫做极性键。
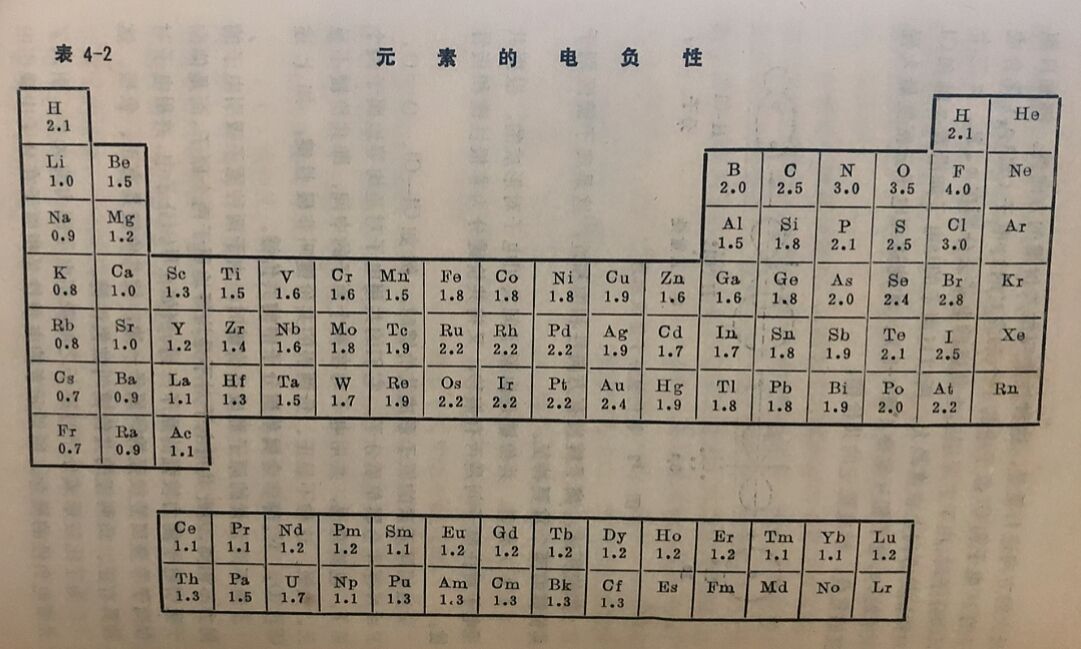
为了比较形成分子时原子之间吸引电子能力的大小,引入了元素电负性的概念。所谓元素的电负性是指原子在分子中吸引电子的能力。元素的电负性大,表示吸引电子的能力强。通常规定以金属锂的电负性为1.0作标准(或非金属元素氟的电负性为4.0作标准),然后通过比较而得到其它元素电负性的相对值,如表4-2所示。
从表4-2中可看出,元素的电负性在同一周期中主族元素的电负性自左至右逐渐增夫,在同一主族中自上到下逐渐减小;位于周期表右上角的元素电负性最大,位于周期表左下角的元素电负性最小。碱金属和卤素的电负性相差最大,它们相互作用时,发生电子的转移,形成典型的离子键。在周期系中间的几族元素,电负性的差别逐渐减小,当它们相互作用时,一般形成极性不等的极性键。非极性键只有在同种元素的原子间才可能形成。因此用元素的电负性值,可大致判断化学键的类型,以及共价键极性的大小。
上述化学键可以H一H、CI—CI、H—Cl、Na⁺CI⁻为例,概括如下:
共价键和离子键是化学键的两种基本类型。根据键极性的概念,共价键和离子键没有严格的界限,离子键可以看作是最强的极性键。极性共价键是由非极性键到离子键的过渡形式,非极性键和离子键则是两种极端情况。从电子得失的观点来看,离子键和共价键有着显著的不同,离子键有电子的得失(或转移),而共价键中的共用电子对为两个原子所共有,只是偏移的程度有所不同而已。