离子键
铜臭 / 2022-07-19
1.离子键的形成。从惰性气体原子的电子层结构特别稳定这一事实出发,有人提出了离子键形成的理论:当原子与原子化合时,最外层电子数少于8的原子,有可能失去或得到电子,使其外层变为与惰性气体相同的电子层结构,而成为带电荷的正离子和负离子。例如钠与氯化合生成氯化钠时,钠将最外层上的一个电子给予氯原子,而成为带正电荷的钠离子(Na⁺);氯原子外层有7个电子,当得到这一个电子后就变成带负电荷的氯离子(OF⁻),这样它们的外层都成为和惰性气体相同的电子层结构。由于带相反电荷的离子之间产生静电引力,使它们互相吸引而彼此靠近。但当它们充分接近时,电子层之间又产生排斥力,当吸引力和排斥力相等时,正、负离子便保持一定距离运动着。这一过程可用下列式子来表示,式中e代表电子:

这种由带相反电荷的正、负离子彼此间靠静电引力而形成的化学键叫离子键(或电价键)。由离子键结合而成的化合物叫离子化合物,很多盐类和金属氧化物都是离子化合物。
在离子化合物中,元素的化合价就是离子所带的电荷数,叫做离子价或电价。离子的电价数就是原子变成离子时所失去或得到的电子数,失去电子的为正价,得到电子的为负价。例如在NaCI中,Na失去1个电子是+1价,CI得到1个电子是一1价。而在CaO中,Ca是+2价,O是-2价。形成化合物时,某原子失去的电子总数等于另一原子得到电子的总数。所以,离子化合物中正、负离子价总数的代数和等于零。
在离子化合物中,由于离子可以近似地看作是球形的,它的电荷分布也是球形对称的。因此,它在各个方向都可以吸引与其所带电荷相反的离子,也就是说,离子键没有方向性。并且一个离子只要在空间条件许可下,可以同时和几个异号离子相结合,如NaCI结晶中每个Na⁺和6个Cl相结合,每个Cl⁻和6个Na⁺相结合,故离子键没有饱和性。
2.离子的特征。带电荷的离子是形成离子化合物的基本微粒。因此离子的性质,在很大程度上决定着离子化合物的性质。
离子具有三个重要特征:离子的电荷、离子的半径和离子的结构类型。分述于下:
(1)离子的电荷。离子电荷越多,对相反电荷的离子吸引力就越强,键能就越大。因此,离子的电荷会影响到离子化合物的一.些物理性质,例如溶解度:同种金属元素的氧化物与硫化物比卤化物要难溶于水,原因之一是由于氧离子和硫离子所带电荷比卤素离子为多,键能较大的缘故。
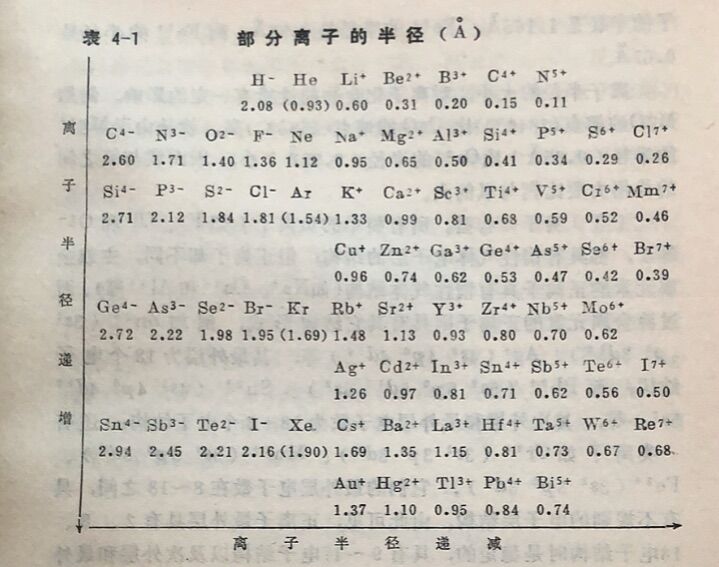
(2)离子的半径。同原子一样,可近似地把离子看成是球形的,因而离子也具有离子半径。离子半径的大小决定着正、负离子间的距离,也是决定离子间静电引力大小的重要因素。表 4-1列出部分离子的半径。表中所示一-般 低电荷离子半径的数据, 是从离子晶体中实际测出的;高电荷离子的半径( 如P⁵⁺、S⁶⁺和Cl⁷⁺等)实际上并不存在,是通过理论计算求得的。
在周期系中,离子半 径也显示出某些规律性变化:在表4-1中同一横行离子的电子层数相同,从左向右,由于核电荷数逐渐增大,因此离子半径递减z对于同一主族和同一副族的同价态离子,从上至下,由于电子层数依次增多,故它们的离子半径依次增大。
当原子失去电子形成正离子时,核外电子层数减少了,原子核对离子的外层电子引力则相对加强,使半径趋于缩小,故正离子半径小于其原子半径,如Na原子半径为1.572Å,而Na+半径只有0.95Å。
当原子得到电子形成负离子时,外层电子层数未变,但电子数增多,原子核对外层电子引力则相对减弱,使半径趋向增大,故负离子半径大于其原子半径,如CI原子的半径是0.994Å,而CI⁻的半径达1.81Å。
对于同一元素的正离子,离子价数越大,表示失去的电子数越多,因而半径就越小。例如铁有Fe²⁺和Fe₃⁺两种离子,Fe原子的半径是1.165Å, Fe²⁺的半径是0.83Å,而Fe³⁺的半径是0.67Å。
离子半径的大小,对离子化合物的性质有一定的影响。例如MgO的熔点(2840°C)比CaO的熔点(2585°C)高,就是由于Mg²⁺ 的半径(0.65Å)比Ca²⁺的半径(0.99Å)小,因而镁与氧之间的作用力要比钙与氧的大。
(3)离子的构型。所有简单的负离子(如F⁻、Cl⁻和O²⁻等),都具有惰性气体电子层的结构;但正离子却不同,主族金属元素的正离子具有惰性气体结构(如Na⁺、Ca²⁺和A1³⁺等),而 过渡金属元素的正离子则具有其它结构形式,例如Zn²⁺(3s² 3P⁶ 3d¹⁰)、Ag⁺(4s² 4p⁶ 4d¹⁰)等,其最外层为18个电子结构;而Pb²⁺(5s² 5p⁶ 5d¹⁰ 6s²)、Sn²⁺ (4s² 4p⁶ 4d¹⁰ 5s²)等,其次外层和最外层电子数为18+2个电子结构;还有一类离子如Cr³⁺(3s² 3p⁶ 3d³)、 Mn²⁺(3s² 3p⁶ 3d⁵)、 Fe²⁺(3s² 3p⁶ 3d⁶),它们的最外层电子数在8~18之间, 具有不规则的电子层结构。由此可见,正离子最外层具有2、8、 18电子结构时是稳定的,具有9 ~17电子结构以及次外层和最外 层有18+ 2电子结构时,也都是稳定的。
离子的构型对离子型化合物性质,也有一定的影响。例如碱 金属和铜副族同属于第Ⅰ族,都能形成+ 1价的离子,但它们相 应的化合物性质却有较大的区别。如NaCl 和KCI易溶于水,而 AgCI则难溶于水,虽然影响它们溶解度的因素比较多,但主要 是由于Na⁺的电子层构型(2s² 2p⁶)和Ag⁺的电子层构型(4s² 4p⁶ 4d¹⁰)不同所引起的。
总之,在比较不同的离子化合物性质时,应该综合考虑离子的上述三个特征。