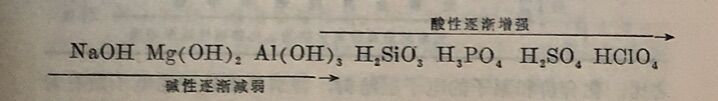元素的性质和原子结构的关系
铜臭 / 2022-07-19
各种元素表现出不同的性质,其根本原因是它们的原子结构不同。零族元素(He、Ne、Ar、Kr、Xe、Rn)的化学性质很不活泼,在常温下都是气体,以单原子分子存在,在一般情况下很难和其它元素相互化合,故称为惰性气体。这是因为该族元素具有特殊的外层电子结构,即除He原子的最外层只有两个电子外,其它的原子最外层都是8个电子,电子壳层特别稳定。人们就以这种电子壳层为惰性壳层或稳定壳层,作为研究、比较其它元素性质的依据。各种元素的原子都有得到或失去电子的倾向,使其外层电子达到稳定壳层。
下面讨论元素的金属性和非金属性以及元素化合价变化与原子结构的关系。
一、元素的金属性和非金属性
典型金属最外层电子数一般小于4,容易失去最外层电子而成为带正电荷的正离子。例如钠原子的电子排布为1s²,2s²2p⁶,3s¹,失去3s¹电子后,成为带一个正电荷的钠离子,电子排布成为1s²,2s²2p⁶;此时具有8个电子的次外层成为稳定壳层的最外层。典型非金属最外层电子数一般大于4,容易得到电子而成为带负电荷的负离子,例如氯原子的电子排布为1s²,2s²2p⁶,3s²3p⁵,得到一个电子后成为带一个负电荷的氯离子,电子排布 成为1s²,2s²2p⁶, 3s²3p⁶, 此时最外层成为有8个电子的稳定壳层。因此常以金属性的强弱表示原子失去电子能力的大小,以非金属性的强弱表示得到电子能力的大小。也就是说,愈易得到电子,则其非金属性愈强,愈易失去电子,则其金属性愈强。原子失去电子或得到电子成为稳定电子层结构的难易程度,首先是与该元素原子的电子层结构,特别是和其最外层电子数有关。一般说来,外层电子数较少的原子较易失去电子,元素的金属性较强;反之,外层电子数较多的原子,较易得到电子,则元素的非金属性较强。
其次,元素原子失 去或得到电子的难易,还和原子核对外层电子引力的强弱有关;而核对外层电子引力的强弱,则与原子的核电荷数及原子半径有关。原子半径就是原子核到最外电子层的平均距离,它可以通过实验测定或由理论计算求得,各元素的原子半径如图3-6所示。一般地说,如果原子的电子层结构相似时,核电荷数越少,原子半径越大,则核对外层电子引力越小,原子就易失去电子,因此元素的金属性越强;反之,原子的核电荷数越多,原子半径越小,则核对外层电子的引力越大,原子就越难失去电子,因此元素的非金属性越强。总之,根据元素原子的最外层电子数、核电荷数和原子半径的大小三种因素,可以比较元素金属性和非金属性的强弱。
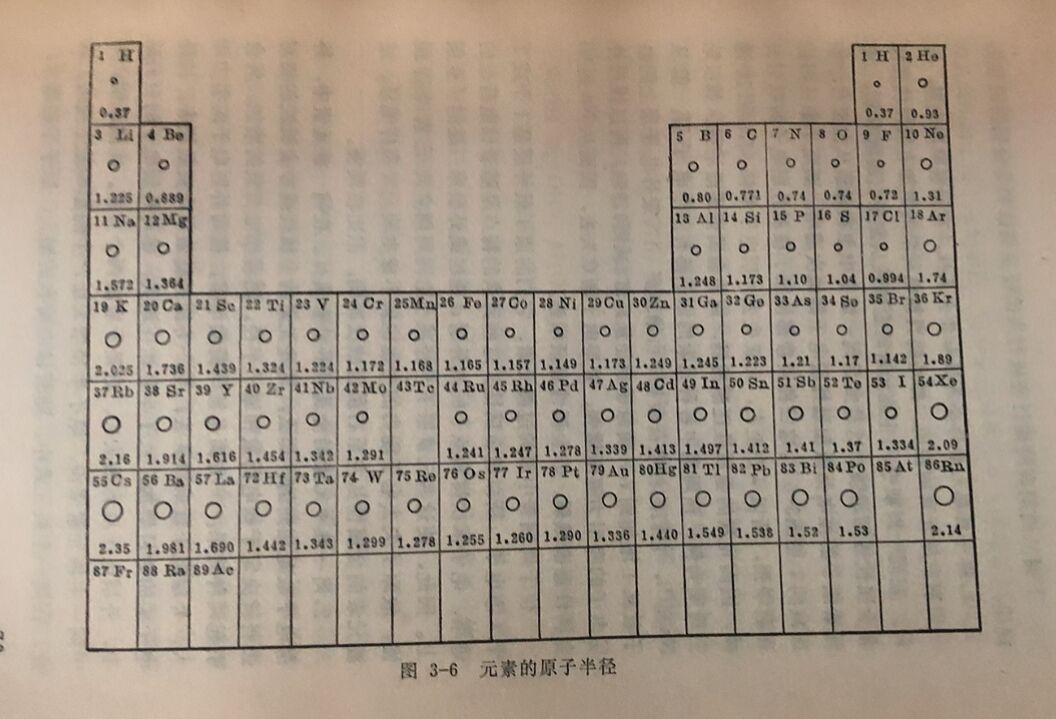
下面从周期表的横行和纵行来比较金属性和非金属性的变化规律;
1.同一周期元素的金属性和非金属性。在元素周期表里,向一周期主族元素的性质,都是随着核电荷数的增加有规律地变化着。在同一周期中,主族元素的金属性从左至右逐渐减弱,简非金属性逐渐增强。这悬由于同一周期中主族元素从左至右,各元素原子的核电荷数和最外层电子数依次递增,而原子半径则是递减的(见图2-6)。这三种因素都使原子核对外层电子的吸引力逐渐增强,所以从左至右,元素失去外层电子的倾向,依次递减,因而元素的金属性逐渐减弱,而非金属性逐渐增强。如以第三周期为候,该周期中各种元素的原子都有三个电子层,但从 Na到Cl,它们的核电荷数从+11增加到+17,最外电子层上的电子数从1增加到7,而原子半径从1.572减到0.994,所以核对外层电子的吸引力逐渐增强,外层电子渐难失去,因而从Na到CI金属性逐渐减弱,非金属性逐渐增强。
位于周期表中部的过渡元素,它们的原子最外层是1个或2个s态电子,所以显金属性。这些元素的特点是随着核电荷数的递增,电子依次排到原子的次外层d亚层或外数第三层的f亚层上。因此,使这些元素原子半径减小比同周期主族元素来得级慢,故原子失去电子能力的变化也就不象主族元素那样明显。过渡元素的金属性从左至右虽也依次减弱,但比较缓慢。
2.同一族中元素的金属性和非金属性。在同一族元素中,外层电子数是相同的。那么,这些元素的金属性或非金属性的相对强弱就决定于核电荷数和原子半径。随着核电荷数的增加,将会引起两种效果:一方面是核电荷数增多,核对外层电子的引力增大,外层电子就难以失去;另方面是随着核电荷数增多,核外电子层的数目增加,原子半径相应增大,核对外层电子的引力孩少,外层电子反容易失去,这是矛盾的两个方面。实践证明,对 于间一主族元素来说, 原子半径增夫所产生的影响是主要的。因此,在同一主族元素中,随着核电荷数的增大,原子半径增大,核对外层电子的引力减弱,原子失去电子的倾向增大,所以元素的金属性由上而下逐渐增强,而非金属性由上而下逐渐减弱。
在同一副族元素中,随着核电荷数的增多,原子半径也相应地增大,但由于原子半径增大较小,因此,由半径增加使电子较易失去的倾向是次要的,而因核电荷数增加对电子所增加的引力则是主要的,总的结果是核对外层电子引力增大,原子失去电子的倾向减小。因此在同一副族中(钪副族除外,因其原子半径增大较显著),从上到下,随着核电荷数的增多,元素的金属性一般是减弱的。
各元素化合物的性质与元素的性质一样,也是随着核电荷数递增而表现出明显的规律性。在同一周期里,各元素最高价氧化物的水化物,从左至右,碱性逐渐减弱,酸性逐渐增强。例如第三周期里各元素氧化物的水化物的酸碱性变化:
在同一主族里,各元素最高价氧化物的水化物,从上到下碱性逐渐增强,酸性逐渐减弱。例如,第I主族中各元素氧化物的水化物的碱性变化:

综上所述,除副族元素和第疆族元素都是金属外,各主族元素的金属性和非金属性,以及它们最高氧化物的水化物酸碱性的变化规律可用表3-5概括。
在表3-5中,从左到右,从下到上,元素的非金属性逐渐增强,元素最高价氧化物的水化物酸性逐渐增强;从右到左,从上到下,元素的金属性逐渐增强,元素最高价氧化物的水化物碱性逐渐增强。

二、元素的化合价
元素的化合价是表示各种原子相互化合时,它们间的原子数之比。化合价和原子的电子层结构,特别是最外层的电子数有着密切的关系。当原子相互化合时,原子失去多少电子,它就显多少正价;原子得到多少电子,它就显多少负价。原子中那些离核较远,并在一定的化学反应条件下能脱离原子的电子,称为该元素的价电子。元素的最高化合价一般由价电子数决定。下面讨论零族、主族和副族元素的价电子。
如前所述,零族元素惰性气体的电子层结构十分稳定,其外层电子在一般情况下不能脱离原子,因此它们没有价电子,故它们的化合价为零。
对于主族元素来说,它们电子层结构的特点是电子排到最外层的s或P亚层上,这些电子参与化学反应;而次外层电子已经排满(2、8、18等),这些电子不参与化学反应。主族元素从I到可族的最外层电子数是1到7个,与其族号相同,因此主族元素和氧化合的最高化合价等于其最外层电子数,也等于其所属的族号数(氟和氧例外,因为它们吸引电子的倾向最强,不可能和它们同族元素那样生成正价化合物),所以主族元素的最高化合价在同一周期来看,是由+1、+2、+3...到+7呈周期性的变化。
当元素原子的最外层电子数多于4时(即自第Ⅳ主族起),原子得到电子的能力比较强,倾向于夺得别的原子的电子,使最外层达到8个电子的稳定结构,因而表现为负价。如CH₄、PH₃、 H₂S、HCI中的C、P、S、Cl的化合价依次为-4、-3、- 2、-1。由此可见,从第Ⅳ到Ⅶ主族元素的负价数等于8减去其族号数。
对于过渡元素的化合价,根据它们电子层结构的特点,最后排布的电子在次外层的d亚层上。由于其最外层和次外层电子都未达到较稳定的结构,因此除了它们的最外层电子外,次外层上未充满d亚层上的电子,也能参予化学反应,故也是价电子。例 如,元素铬(Cr )的电子排布是: 1s²,2s²2p⁶,3s²3p⁶,4s¹,3d⁵。其价电子为最外层1个8电子和次外层5个d电子,总数为6,所以它的最高化合价为+6,等于它所在族的号数。但必须注意,这一规律不完全适用于第Ⅷ族元素。在第Ⅷ族元素中,只有钉(Ru)和锇( Os)能生成+ 8价的化合物(如RuO₄,OsO,₄),其它元素如Fe、Co和Ni一般都只能生成较低价的化合物,常见的化合价是+2、+3。
副族ⅠB和ⅡB元素的最外层s电子数是1和2,次外层已达稳定的1s电子层结构。在一般情况下,它们的最外层电子就是价电子,所以最高化合价也等于其族号数。但铜(Cu)、 金(Au)例外,它们的d电子根据反应条件的不同,也可以部分地参加反 应。例如铜能生成稳定的+ 2价化合物(如CuSO₄),金能生成 十3价化合物(如AuCI )。
总之,过渡元素由于原子的电子层结构上的特点,其化合价可随着反应条件的不同,表现出变价性质。