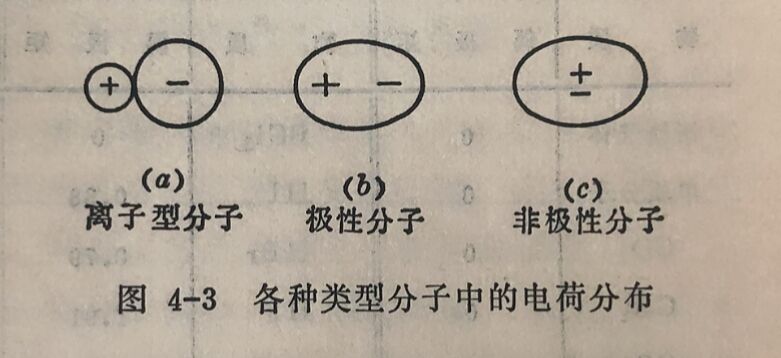
图4-3中“+”和“-”分别表示正、负电荷重心的相对位置,叫做分子的正极和负极。每个极性分子为一偶极,正、负电荷重心间的距离叫做偶极长度(l)。偶极长度可表示分子极性的强弱,不同的极性分子具有不同的偶极长度,偶极长度愈长,分子的极性愈强。如果正、负电荷重心分离得很远,这个分子就属于离子型分子,因此,也可以说离子型分子是极性最强的分子,如图4-3(a)。
由于分子的偶极长度不易测得,而它的偶极距(μ)是可以测得的,因此分子极性的强弱,实际上是用实验测出的偶极矩 (μ)来量度的。分子的偶极矩等于偶极长度(I)乘以极的电量(e)。即:
μ=l·e
因为1个电子的电量为4.8X10⁻¹⁰绝对静电单位,而偶极长度不会超过分子的大小,故它和分子的直径有相同的数量级,即10⁻¹⁸厘米,所以偶极矩大小的数量级为10⁻¹⁸绝对静电单位·厘米,习惯上,把10⁻¹⁸绝对静电单位·厘来作为偶极矩的单位,叫1德拜(简写为1 D)。如实验测得水分子的偶极矩为1.85×10⁻¹⁸绝对静电单位.厘米,即等于1.85D。分子的偶极矩越大,其极性也越大,当分子的偶极矩等于零时,则为非极性分子。妆根据偶极矩的大小可直接衡量分子极性的大小。表4-3中所列的为一些物质的偶极矩。
表4-3 某些物质的偶极矩(单位:德拜)
| 物质 |
偶极矩 |
物质 |
偶极矩 |
物质 |
偶极矩 |
| 惰性气体 |
0 |
BCl₃
|
0 |
H₂S
|
1.1 |
| 单质分子 |
0 |
Hl |
0.38 |
NH₃
|
1.46 |
CO₂
|
0 |
HBr |
0.79 |
SO₂
|
1.61 |
CS₂
|
0 |
HF |
1.91
|
H₂O
|
1.85 |
CCl₄
|
0 |
HCl |
1.03 |
HCN |
2.1 |
由表4-3可知,以极性键组成的多原子分子,并不一定都是极性分子。例如CO₂就是非极性分子,这是因为多原子分子的极性和极性的大小,不仅和化学键的极性有关,而且还与分子的构型,即分子中组成原子的空间排列有关。
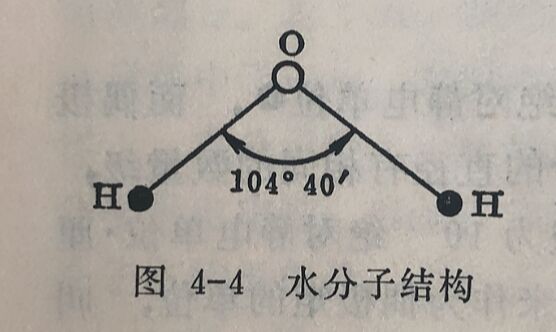
由偶极矩的测定,可以帮助我们了解物质的分子构型,例如实验测得CO₂的偶极矩为零,由此可推断CO₂分子一定具有直线对称结构,即O=C=O。尽管碳氧之间键的极性并不小,但在分子中两个氧和碳之间键的极性却彼此抵销,因此CO₂是非极性分子。又如测得H₂O分子的偶极矩大于零,由此可以推断H₂O分子中的两个H—O键并不是直线对称的,而是有角度的。实验测得H₂O分子中两个H—O键之间的键角为104°40'(如图4-4所示)。
总之,在简单的双原子分子中,分子的极性是与组成该分子的键的极性相一致的。 如双原子间的键是非极性键,它的分子就是非极性分子;如双原子间的键是有极性的,它的分子就是极性分子。但对多原子分子来说,分子是否有极性,还要看分子的结构是否对称,如果结构是对称的,虽然各个共价键是有极性的,但整个分子仍没有极性。显然如果分子的结构不对称,那末键的极性不会抵销,因此它的分子就是极性分子。