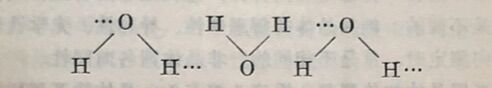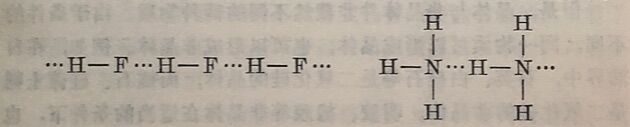分子间的作用力和氢键
铜臭 / 2022-07-19
物质的性质与它们的化学键类型很有关系,但是物质的性质不仅决定于其化学键,还与它们分子间存在的作用力有关。例如卤族元素的分子在常温常压下,F₂、Cl₂是气体,而Br₂是易发挥的液体,I₂则是固体。它们所以呈现不同的聚集状态,是因为这些不同分子间的作用力大小不同的缘故。下面首先介绍分子间的作用力,然后再讨论氢键。
一、分子间的作用力
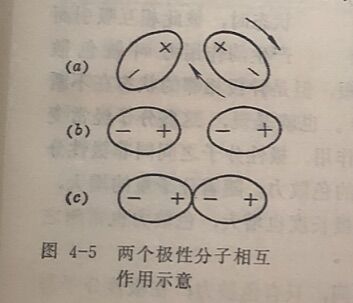
1.取向力。极性分子因本来就有偶极,称为固有偶极。当两个极性分子相互接近时,由于同极相斥和异极相吸,使两个分子发生相对的转动,并按异极相邻的状态,依一定的方向排列,这 一过程叫取向,如图4-5(a)、 (b) 所示。由于固有偶极的取向,而使极性分子相互吸引在一起的作用力,叫做取向力,如图4-5(c)。
2.诱导力。当极性分子和非极性分子相接近时,如图4-6(a),由于极性分子的偶极电场,可以使非极性分子的正、负电荷重心移动而发生极性,成为极性分子。这种由于外来的影响而产生的偶极,称为诱导偶极。诱导偶极与极性分子的固有偶极相吸引,如图4-6(B)。这种由于诱导偶极而产生的作用力,称为诱导力。同样,当极性分子与极性分子相互接近时,除了取向力外,在彼此偶极的相互影响下,每个分子也会发生变形,使它们的正、负电荷重心更加分开,产生诱导偶极,因此诱导力也存在于极性分子之间。
3.色散力。非极性分子不具有偶极,它们之间似乎不会产生什么引力。然而实际上却不然,例如CO₂气体就很容易液化、固化(分子间的距离变小),这说明非极性分子之间也是存在着引 力的。当非极性分子相接近时,图4-7 (a),由于每个分子中各原子的原子核和核外电子在不断运动,经常发生原子核和电子云之间的瞬时相对位移,使某一瞬间正、负电荷重心不重合而形成偶极,我们把这种瞬间产生的偶极叫瞬时偶极。和它相邻的另一个非极性分子也同样会产生瞬时偶极,当它们处于异极相邻状态时,彼此相互吸引而产生的作用力叫做色散力。虽然瞬时偶极存在的时间很短,但是异极相邻的状态在不断地重复着,如图4-7(b)和(c)。也就是说,这些分子经常变形,它们之间始终有色散力在起作用。极性分子之间同非极性分子一样,也存在瞬时偶极和相应的色散力。随着分子量的增大,分子的变形性就增大,其瞬时偶极长度也增大,色散力也常随之而增大。
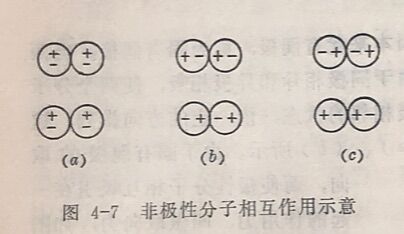
总括起来,在非极性分子之间,只有色散力: 在极性分子与非极吸性分子之间,存在着色散力和诱导力而在极性分子之间,则不仅有取向力和诱导力,而且也有色散力。这些作用力总称为分子间的作用力,也称为范德华引力。这三种类型的力所占的比例,依其相互作用的分子极性和变形性而定:分子的极性愈强,取向力所占的比例就大;分子的变形性愈大,色散力所占的比例就大;诱导力则和这两个因素都有关系。
分子间作用力的大小,还对物质的熔、沸点等物理性质有很大影响。例如,情性气体和卤素的熔点、沸点(见表4-4),常随它们的分子量的增大而升高。这是因为它们都是非极性分子,分子间只有色散力的作用,而色散力是随着分子量的增加而增大,色散力愈大,克服这种引力所需的能量就愈大。因此其熔、沸点相应增高。
表4-4 惰性气体和卤素的熔点和沸点
| 物质 |
分子量 |
熔点(°C)
|
沸点(°C) |
物质 |
分子量 |
熔点(°C) |
沸点(°C) |
| He |
40.0026 |
-272.2 |
-268.9 |
F₂
|
37.997 |
-219.6 |
-187.9 |
| Ne |
20.179 |
-248.7 |
-245.9 |
Cl₂
|
70.906 |
-101 |
-34 |
| Ar |
39.948 |
-189.2 |
-185.7 |
Br₂
|
159.808 |
-7.2 |
58.2 |
| Kr |
83.80 |
-156.6 |
-152.9 |
I₂
|
253.809 |
113.6 |
184.5 |
| Xe |
131.30 |
-112 |
-107.1 |
|
|
|
|
分子间的这种作用力是永远存在的,其能量约为每克分子几千卡,比化学键的键能(几十至一、二百千卡)小几十倍至几百倍,其作用范围只有几个Å。如范围过大时,其作用力就可忽略不计。
二、氢键
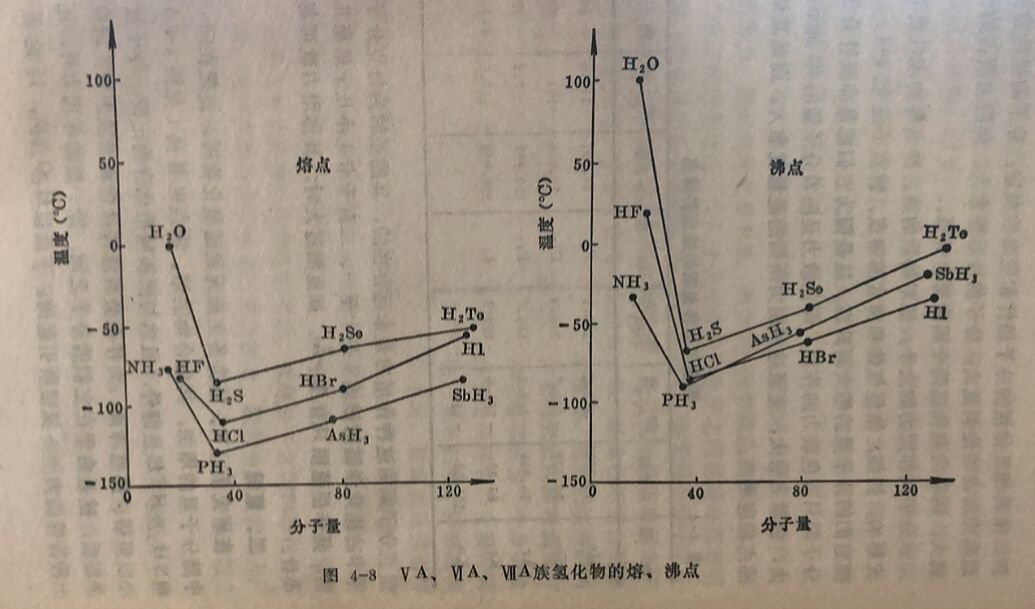
在研究Ⅴ、Ⅵ、Ⅶ类各主族元素的氢化物时,发现在同一族中随分子量的增加,其化合物的熔、沸点也增高(见图4-8),但NH₃及HF却是例外,虽然与同族同型化合物比较,分子量较小,但熔、沸点却高。为什么会有这种反常现象发生呢?研究结果证明,这是由于在它们的分子之间,除一般的作用力外,还有一种特殊的力一氢键所引起的。 下面以H₂O为例,讨论氢键的形成及其特征。
当氢原子与氧原子以共价键结合成H₂O分子时,由于氧的电负性较氢大得多,所以它们的共用电子对强烈地偏向氧原子,使氢原子变成一个几乎没有电子而半径又很小的原子核。因此,这个氢的原子核就不会被另一个水分子中电负性强的氧原子的电子层所排斥,反而被它所吸引,从而形成第二个键。因此氢键实 质上是一种静电引力,一般用点线(···)表示。如水分子形成氢键的结构如下:
由于氢键的形成,可使简单的水分子结合成为较复杂的水分子。这种由简单分子结合成复杂分子而不引起化学性质改变的现象,叫做分子的缔合。
此外,氢原子与其它电负性大的元素(如F、N等)以共价键相结合(如HF及NH₃)时,也能形成氢键,产生缔合分子。
氢键的能量一般在10千卡/克分 子以下,比化学键小得多,与分子间的作用力相接近。如果分子间有氢键存在,会使其沸、熔点升高。这是因为液体气化或晶格熔化时,不仅要破坏分子间的作用力,还必须破坏氢键,因此需要消耗较多的能量。故具有氢键化合物的沸、熔点,比同族同型的化合物要高。





















































.jpg)