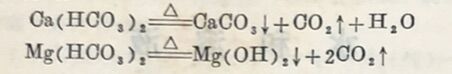所以这种硬度,又称为暂时硬度。钙、镁与硫酸根、氯根所形成的硬度,叫做非碳酸盐硬度。由于这种水的硬度不能用煮沸的方法除去,所以又称为永久硬度。碳酸盐硬度与非碳酸盐硬度的总和称为总硬度。
硬水在制碱、造纸、印染、制药和人造纤维等许多工业部门,都不宜使用,否则会影响产品质量;就是用于洗衣服,也会因肥皂与硬水生成不溶于水的化合物,减少肥皂的泡沫,降低去污能力。硬水煮沸后会生成碳酸钙、氢氧化镁,以及蒸发浓缩后生成的硫酸钙等沉淀物,沉积在器壁上,这种沉淀物叫做水垢。因为水垢传热性差,故如锅炉管壁上结有水垢,则不仅要多消耗燃料,且易造成局部过热,损坏炉管,甚至使炉管爆破。因此,工业锅炉中的用水常需除去水中杂质,即要对水进行处理。溶解在水中的气体,可用加热或加化学药品方法除去;溶解在水中的盐类,则可用蒸馆、沉淀软化、离子交换、电渗析和反渗透等方法除去;不溶于水中的杂质,则可用混凝、澄清和过滤等方法除去。有关水处理方法,可参见《热力发电厂水处理》。
二、水的一般性质
1.水的物理性质。纯水是无色(水层较厚时呈淡蓝色)、无味、无臭的液体。纯水几乎不导电,如果水中溶有盐类等电解质,则导电性增强。水的主要物理性质如下:
(1)密度与比热:
1)密度。物质的密度是表示单位体积中所含该物质的质量(一般以重量代替)。固体和液体的体积单位常采用毫升或厘米³( C.C. ),质量则以克为单位。
一般物质都有热胀冷缩现象,因此它们的密度均随温度的降低而增大。但水的密度与温度的变化却不那么规律;水在4°C(严格地说为3.98°C )时为1克/厘米³,密度最大;高于或低于此温度时,其密度都要减小。水在凝固(结冰)时体积增大,密度减小(冰的密度为0.92克/厘米³)。由于冰的密度比水小,所以冰总是浮在水面。由于水结冰时体积要增大,故有胀破器皿的危险。因此在冬天,对冷水管要注意采取防冻措施。
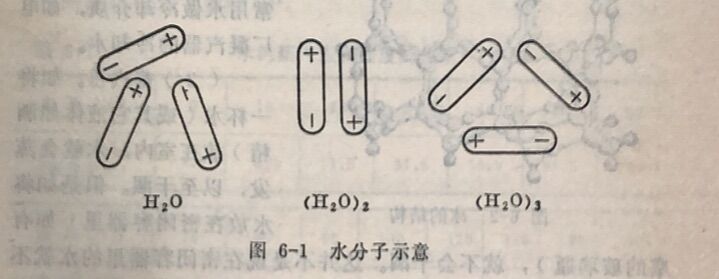
水的密度随温度的变化情况,可用水分子的缔合现象来解释。在第四章中已经谈过,水分子间因有氢键存在,会引起水分子的缔合。也就是说在液态水中,除了简单的水分子以外,闻时 还有由简单的水分子结合而成的(H₂O),₂,(H₂O)₃……(H₂O)ₓ等较复杂的缔合水分子,它们在一定温度下成下列动态平衡:
xH₂O⇔(H₂O)ₓ+热
式中x—2、3、4......等。
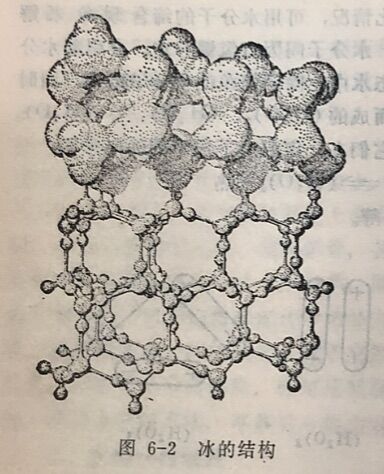
由图6-1可见,双分子水的排列较紧密,三分子水和单分子 水的结构比较疏松。在4°C时,有部分水是由双分子(H₂O),组成的,故其密度大。由于缔合是一个放热过程,故当温度降低时,水的缔合程度会增加,(H₂O)₂会转化为(H₂O)₃,使三分子水(H₂O)₃,的数值增大,所以水的密度减小。当温度降低到0°C 时,全部H₂O分子结合在一 起成为一个巨大的缔合分子一成为冰(如图6-2)。此时,其体积最大,密度比水要小。当温度高于4°C时,水的缔合程度减小,(H₂O)₂解离为H₂O,使单分子H₂O的数量增大,密度减小。因此,在4°C时,水的密度最大,达到1克/厘米³。
2)比热。比热是指1克物质的温度升高(或降低) 1°C所吸收(或放出)的热量,单位是卡/克.度。在所有固态和液态物质中,水的比热最大。1克水温度升高(或降低)1°C,所吸收(或放出)的热量为1卡。由于水中除了有H₂O分子外,还有(H₂O)ₓ分子,当温度升高时,后者分解而成H₂O分子需要吸收热量。因此,水加热时,热量不仅消耗于使水的温度升高,也消耗于分解相政而缔合的水分子,这就是水的比热最大的主要原因。由于水有这种性质,又因其资源丰富,所以工业上常用水做冷却介质,如电厂凝汽器的冷却水。
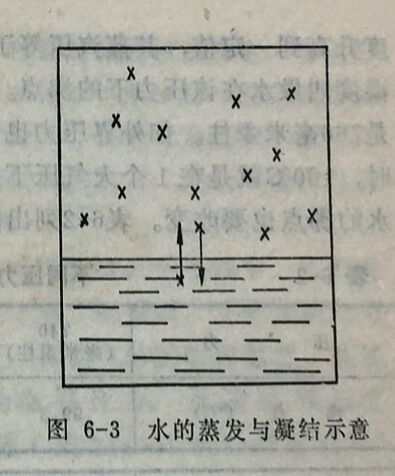
(2)蒸汽压。如将一杯水(或其它液体如酒精)放在室内,水就会蒸发,以至干涸。但是如将水放在密闭容器里(如有塞的玻璃瓶),就不会干涸。这并不是说在密闭容器里的水就不会转化为蒸汽,实际上,在水面上有一部分动能较大的水分子能够克服水分子间相互的引力,逸出水面进入容器的空间成为蒸汽,这一过程称为蒸发;同时进入容器空间的水蒸气分子也在不断地运动,经常有一部分蒸汽分子碰到水面为液面水分子所吸引,又返回到液体中来,这个过程称为凝结,如图6-3。显然,在容器空间的蒸汽分子愈多,凝结速度就愈快。因此,将水放在密闭容器中,在蒸发初期,蒸发速度比凝结速度大,随后当空间
蒸汽分子逐渐增多时,凝结速度便也逐渐增大。经过一定时间后,凝结速度与蒸发速度就会相等,此时液面上蒸汽浓度就不再改变,即达到下列动态平衡:
在某温度下,达到平衡时的蒸汽叫做该温度下的饱和蒸汽。这时的蒸汽压力称为该温度下水的饱和蒸汽压,或简称蒸汽压。
























![水杨酸甲酯[冬青油]](images/201812/thumb_img/964_thumb_G_1545823931913.jpg)