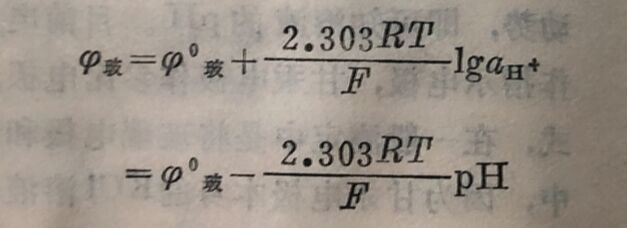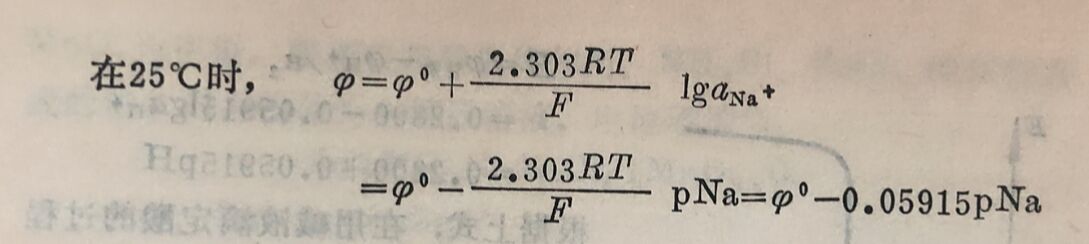在25°C时,则为: φ玻=φ⁰玻一0.05915pH
φ⁰玻是一个常数,它的数值与管内所用内参比电极、管内溶液的pH以及玻璃膜的性质有关。由于玻璃膜的表面状态常因制造工艺的差异而不同,所以即使采用相同的内参比电极和相同成分的玻璃制成的玻璃电极,其φ⁰玻值也各不相同。但对于支给定的玻璃电极来说,φ⁰玻是一个常数。在应用时通常先用已知pH值的缓冲溶液测定φ玻求出φ⁰玻,然后再测定未知溶液的φ玻计算其pH值。
玻璃电极|未知pH液||参比电极(甘汞电极)
电池的电动势: E=φ甘汞一φ波= φ甘汞一(φ表一0.05915pH)
因为φ甘汞和φ⁰玻的值为已知,测得了电池的电动势E,即可求出溶液的pH值。
用电位法测pH时,若内参比电极和外参比电极相同,玻璃膜内外落放的田值也相同,这时电池的电动势应等于零。但实验结果其电动势并不等于零,而约为1~20毫伏,这种电位称为不对称电位。这是由于玻璃膜两边的表面状不是完全相同所引起的。因此,不对称电位的大小,与玻璃膜的制造工艺和表面状态有关。对给定电极来说,不对称电位是一个常数,但不同电板的不对称电位各不相同。上述的φ⁰玻,已包括了不对称电位。
用一般质量的玻璃电极测定H值为1~9的溶液,效果较好。如pH超过9时会发生“碱差”或“钠差”。因为在碱性溶液中Na⁺浓度较大时,Na⁺可以和H⁺一样从玻璃膜的表面扩散进去,但其量比H⁺小得多。当达扩散平衡时的膜电位就与只有H扩散时不同,使测得的pH值较实际的低,即测得的H⁺浓度偏高。可以改进玻璃的化学成分,使金属离子不易在膜中扩散来减少这种误差。例如现在生产的以Li₂O 代替Na₂O的Li₂O-CaO-SiO₂组分的高碱玻璃电极,可测到pH=13,pH=13以上才有“碱差”。
玻璃电极的电阻很大,一般可达10~500兆欧姆,因此不能用通常的电位计来测量电动势,而必须用电子管伏特计。这种以玻璃电极专门来测溶液pH的仪器叫做pH计或酸度计。在这种表计上已将测得的电动势的毫伏数换算成相应的pH值,因此可以直接读得p耳值。用玻璃电极测定pH的优点为:测定时样品的组成不发生变化,不受氧化剂和还原剂的影响,可用于有色和混浊的溶液,测定速度快且较精确,此外便于实现自动控制和自动操作。
选用电极时,应注意其适用的p五范围。使用时应保护玻璃球膜,勿使破裂和沾污。使用前,先将玻璃球浸泡在蒸僧水中,使玻璃膜表面膨胀,以便离子从表面扩散。使用时,先用待铡溶液冲洗玻璃电极,再插入待测溶液并稍待片刻,使离子扩散达到平衡后再进行测定。
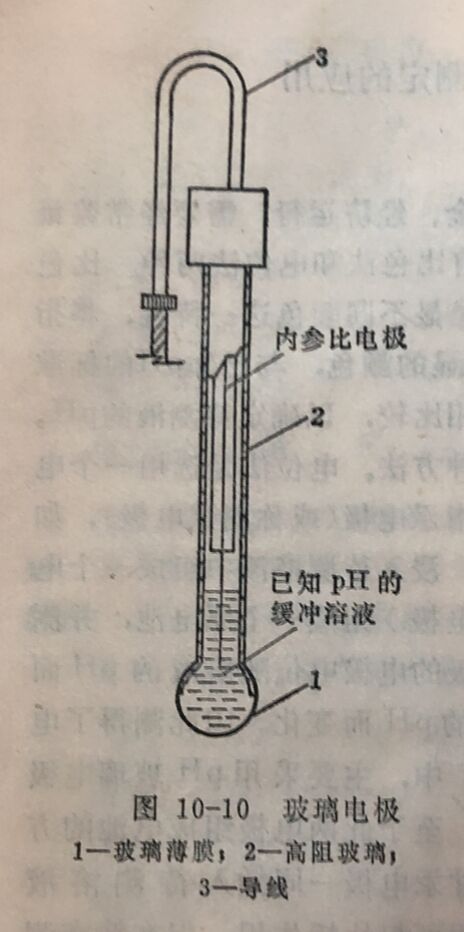
“pH玻璃电极”是利用一种特殊玻璃的膜,只有H⁺能在其表面扩散,也就是说这种玻璃对H⁺敏感,或者说对且有选择性。现在已选用不同的玻璃化学成分,制造了对Na⁺、K⁺和Ag⁺等敏感的玻璃电极,用来测定相应的离子。这些电极的结构和pH玻璃电极相同,电极中的内参比电极-一般仍用Ag-AgCl电极,只是球内的溶液则相应改为已知浓度的Na⁺、K⁺和Ag⁺溶液。
以后人们又采用非玻璃材料,如用卤化物的沉淀物、离子交换树脂等作薄膜,并扩大到可以测定溶液中的阴离子如Cl⁻、I⁻、NO₃⁻、CN⁻等,目前已试制成功有二十余种电极,这些电极都是利用特制的薄膜,只能与溶液中的某种离子建立平衡,所以这类电极又称为离子选择性电极。它是六十年代才迅速发展起来的一种快速 简便的分析技术。它通过简单的电动势测量,直接得出溶液中某种离子的活度。
离子选择性电极的种类很多,各有其不同的结构和原理,下面介绍钠离子选择性电极(即pNa电极)。
二、测定溶液的pNa值
过去电厂测定水、汽中Na⁺浓度往往需要较长的时间,现在采用pNa电极法来测定,几分钟就能完成。pNa表示Na⁺活度的负对数:
pNa=-lgaNa⁺
pNa电极是上述离子选择性电极中的一种,选用的玻璃对Na⁺敏感。pNa电极的结构与pH玻璃电极的基本一样,如图10-11所示。
当把pNa电极浸入待测Na⁺活度的溶液中时,由于玻璃膜两边Na⁺活度的不同而产生电位差。电位差的大小决定于玻璃膜外溶液中Na⁺的活度,其关系式如下:
用pNa电极测定Na⁺的活度( pNa)和用pH玻璃电极测定 H₃活度( pH )的原理相同。测定时,将pNa电极和参比电极(如甘汞电极)浸入待测Na⁺活度的溶液中构成原电池,用pNa 计测它的电动势。根据上式,在25°C时pNa每改变 1个单位(即Na⁺活度变化10倍),相应的电动势改变59.1毫伏。由于pNa计本身已将测得电动势的毫伏数换算成相应的pNa值,因此测定时可以直接读出pNa值。
pNa玻璃电极与pH玻璃电极一样也有不对称 电位。此外,氢离子对钠离子的测定也有干扰(其它1价阳离子达一定活度时也有干扰)。故测定Na⁺活度时要调节溶液的pH值(一般加入二异丙胺,使pH提高到10左右),以减少H⁺对Na⁺的测定干扰。







![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)








![硫酸铈标准溶液浓度 c[Ce(SO4)2] = 0.1500 mol/L价格](images/202207/thumb_img/1632_thumb_G_1656925752112.jpg)



![硝酸铜标准溶液 c[Cu(NO3)2]= 0.01000 mol/L价格](images/202207/thumb_img/1653_thumb_G_1658537651764.jpg)