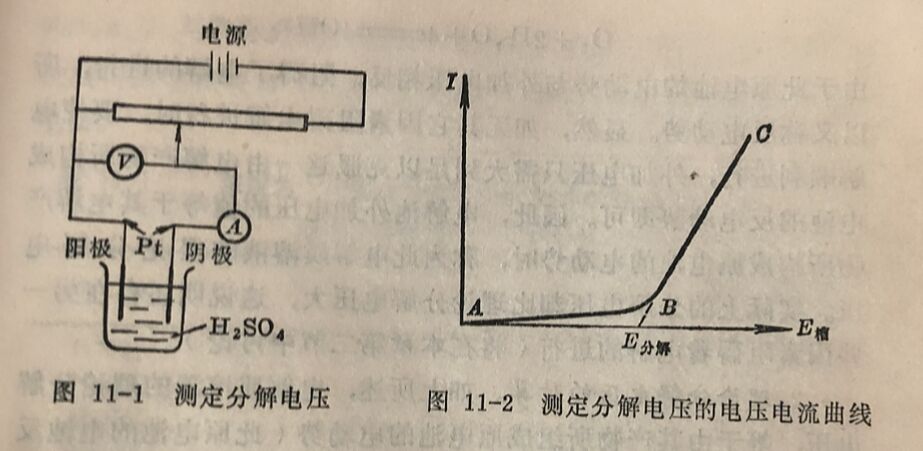
当外加电压很小时,电解槽中几乎没有电流通过,电压逐渐增 加,电流也只有很小的增加,如A B线段;当外加电压继续增加到一定数值后,电流随电压增加而显著增加,几乎成直线(如BC线段所示)上升,同时两个电极上分别有H₂和O₂的气泡逸出, 电解顺利进行。在图11-2中将 B C直线延长与横坐标相交于E,此交点的电压就是分解电压。
二、理论分解电压
1.理论分解电压的实质。电解时所以需要一定 的分解电压是因为当电流通过H₂SO₄溶液时,溶液中的H⁺向阴极迁移,并在阴极放电而生成氢气;溶液中的SO₄²⁻和OH⁻(由H₂O电离而得)则向阳极迁移,在阳极上SO₄²⁻不放电,OH⁻放电。两极反应为:
2H⁺+2e=H₂
4OH⁻=O₂+2H₂O+4e
生成的氢气和氧气分别吸附在阴极和阳极两个铂片上,在H₂SO₄溶液中成为相应的氢电极和氧电极,组成一原电池:
Pt,H₂IH₂SO₄(1N)|O₂,Pt
其中氢电极为负极,氧电极为正极,其电极反应为电解时电极反应的逆反应:
H₂=2H⁺+2e
O₂+2H₂O+4e=4OH⁻
由于此原电池的电动势与外加电压相反,阻碍了电解的进行,所以又称反电动势。显然,如无其它因素阻碍电解进行时,要使电 解顺利进行,外加电压只需大到足以克服这- 由电解产物所构成电池的反电动势即可。因此,电解池外加电压的值等于其电解产物所构成原电池的电动势时,称为此电解质溶液的理论分解电压。实际上的分解电压却比理论分解电压大,这说明还存在另一些因素阻碍着电解的进行。
2.理论分解电压的计算。如上所述,电解质溶液的理论分解电压,等于由其产物所组成原电池的电动势(此原电池的电池反应恰为电解反应的逆过程)。由于原电池的电动势等于正、负两极还原电位之差,而两极的电极电位可用能斯脱公式计算,即理 论分解电压可用计算求得。如上述1NH₂SO₄溶 液的理论分解电 压可计算如下:假定1NH₂SO₄完全电离, 并近似地用浓度代替活度,则:
[H⁺]=1克离子/升, [OH⁻]=10⁻¹⁴克离子/升
由于在电解时,氢气和氧气都从溶液中逸出,因此它们的分压力都是1个大气压,则氧电极的理论电极电位为:
即1NH₂SO₄的理论分解电压为1.23伏,而实际测得1NH₂SO₄的分解电压却为1.67伏。
与理论分解电压相对应的电极电位,称为理论分解电位或理 论析出电位,其值可用能斯脱公式计算,如上述φo₂+H₂o/oH⁻和φH⁺/H₂。







![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)








![硫酸铈标准溶液浓度 c[Ce(SO4)2] = 0.1500 mol/L价格](images/202207/thumb_img/1632_thumb_G_1656925752112.jpg)



![硝酸铜标准溶液 c[Cu(NO3)2]= 0.01000 mol/L价格](images/202207/thumb_img/1653_thumb_G_1658537651764.jpg)