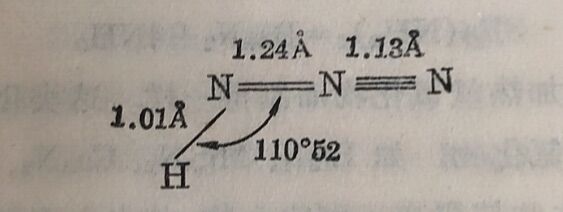氨的衍生物
铜臭 / 2022-07-25
从氨分于NH₃内去掉一个氢原子,則得一价基—NH₂,此—NH₂称为氨基。两个氨基相联則形成H₂N-NH₂,称为联氨(肼)。若氫氧基—OH与氨基相联,則得羥氨(胲)。以金屬取代氨的一个氩原子,則生成金屬的氨基化物,例如氨基化鈉NaNHg。从氨分子内取走两个氫則得二价基=NH,称为亚氨基。从亚氨基衍生而得的化合物称为亚氨基化物。氮化物可看成是氨分子的三个氫为电正性元素所取代而形成的化合物。
(i)联氨(肼)N₂H₄制备联氨的方法:先用氯处理稀氨溶液,得氯氨NH₂Cl,然后加过量的氨即形成联氨,反应为
2NH₃+Cl₂=NH₂Cl+NH₄CI
2NH₃+NH₂Cl=N₂H₄+NH₄Cl
联氨的硫酸盐N₂H₄·H₂SO₄或(N₂H₅)₂SO₄,微溶于冶水,加热时溶解度增高,故硫酸盐的秸晶作用可用来提精联氨。純净的联氨为无色液体,熔点1.4°C,沸点113.5°C,与水互溶,它的水溶液显弱 碱性(Kb₁=8.5x10⁻⁷, Kb₂=8.9x10⁻¹⁶)。
在秸构和若干化学性质上,联氨与氦的关系同过氧化氢与水 的关系頗为类似。在气态时,N—N的键长为1.47Å与过氧化氢在气态时的O—O的键长相同。在水溶液内,联氨既显还原性,也显氧化性。这由它的电偶电位可以看出,
在酸液内
N₂H₅⁺+3H⁺+2e⇔2NH₄⁺ E⁰=124伏
N₂+5H⁺+4e⇔N₂H₅⁺ E⁰=-0.17伏
在碱液内
N₂H₄+2H₂O+2e⇔2NH₃+2OH⁻ E⁰=0.1 伏 N₂+4H₂O+4e⇔N₂H₄+4OH⁻ E°=-1.15 伏
由电位数据可見,在酸液内联氨的正电位高,故为强氧化剂,在破液内負电位高,故为强还原剂。
(ii)羥氨(胲) NH₂OH現在一般用电解法在鋁阴极 上还原硝酸以制备羥氨:
HONO₂+6H⁺+6e=HONH₂+2H₂O
較旧的工业方法是,在0°C时于中性NaHSO₃溶液内用亚硫酸还原亚硝酸,先产生二磺酸羥氨,然后在酸溶液内加热,使之水解而 生成硫酸羥氨:
NO₂⁻+SO₂+HSO₃⁻=HON(SO₃)₂⁻⁻
HON(SO₃)₂⁻⁻+2H₂O=HONH₃⁺+H⁺+2SO₄⁻⁻
純净的羥氨是固体,熔点33°C,沸点57°C (在22毫米时),易溶于水。它的溶液显弱碱性(Kb=6.6x10⁻⁹)。这个固体碱不稳定,在15°C以上即分解,主要反应为
3NH₂OH=NH₃+N₂+3H₂O
也有一部分分解为氮的氧化物:
4NH₂OH=2NH₃+N₂O+3H₂O
羥氨在水溶液内比較稳定,它的盐也稳定。
羥氨分子可看作是由过氧化氢和联氨分子的各半联合而成。它既是强氧化剂,也是强还原剂。
(iii)金属氨基、亚氨基和氮化物在 上节时論氨的性质时,已羥提出NH₃分子中三个纸逐一被金屬取代所成的化合物依次称为金属氨基化物、亚氨基化物和氮化物,它們与水体系的金屬氨氧化物和氧化物相对应。
金屬氨基化物的普通式为M'NH₂。碱金屬、碱土金膨和若干其他金屬如Ag、Zn等皆形成氨基化物。它們皆可由金屬在氨气内加热而制得,例如:
2NHs₃+2Na=NaNH₂+H₂
氨基化鈉是无色晶体,熔点210°C。它的熔体是一种强还原剂,同时又是一种縮合剂,因为它与水起强烈的反应:
NaNH₂+H₂O=NaOH+NH₃
因此,它在有机合成方面有不少应用。
金屬亚氨基化物的普通式为M''NH。亚氨基 化鋰和亚氨基化鉛"是这类化合物的典型。鋰的亚氨基化物的制备方法,是将鋰的氨基化物在其空内加热到熔点左右:
2LiNH₂=Li₂NH+NH₃
亚氨基化鲤是无色晶体,在600°C以下做未熔化,就开始分解。它的化学性质大体与金屬氨基化物相同。
金屬氮化物的通式为M₃'N。許多金屬如鋁、鎂等在加热时可直接与氨化合面生成氨化物。破土金屬的氮化物可用加热氨基化物的方法而制得,俩如:
3Ba(NH₂)₂=Ba₃N₂+4NH₃
正如氧化物可由加热氧氧化物面制得一样。这类化合物可看作是 氨的取代产物的氮化物,如Li₃N、Mg₃N₂, Ca₃N₂、Sr₂N₂、Ba₃N₂. Zn₃N₂.、AIN等,这些皆属离子型化合物,其中大多数可为水所分解面产生金属氩氧化物和氨,例如:
Ba₃N₂+6H₂O=3Ba(OH)₂+2NH₃
但也有若干氮化物不能看作是氨的簡单的取代产物,例如Mn₅N₂、W₂N₃、ZrN 等。它們是属于所謂“简充化合物”,氮原子填充在金屬结构的間際中。一般地說,这类氮化物不易与水起作用。它們有高度的对热稳定性、金局的导电性、高熔点和高硬度。
(iv)氢迭氦酸和送氮化物氢迭氦酸 为无色面有刺鼻臭味的液体,锦点35.7°C,熔点-80°C;一旦与热的物体接触,立即爆炸而分解:
2HN₃=3N₂+H₂ Q=141.8千卡
它溶于水内即稳定,为一弱酸,离解常数Ka=19x10⁻⁵, 故与酯酸的强度相仿佛。因为它的揮发性高,可用不揮发的酸把它从送氦化物内墓出。
在溶解度方面,迭氦化物M'N₃与卤化物相似(11-10节)。 大多数金蜀的送氮化物皆溶于水; Ag、 Hg'和Pb''的盐則不溶。迭氮化鈉NaN₃,是用于制备其他迭氮化物和自由酸的原料。通一氧化二氦于溶化的氨基钠即产生迭氮化鈉:
N₂O+NaNH₂=NaN₃+H₂O
这作用可以进行完全,因为所生成的水可与氨基鈉反应,所以随生随即从产物中移去:
HOH+NaNH₂=NaOH+NH₃
实驗数据证明氢迭氨酸的三个氨原子皆在一一直线上,虽然它們的鍵长略有不同。下式表示其可能的結构:




![2,2-双[4-(4-氨基苯氧基苯)]六氟丙烷](images/202103/thumb_img/3458_thumb_G_1615773264954.jpg)