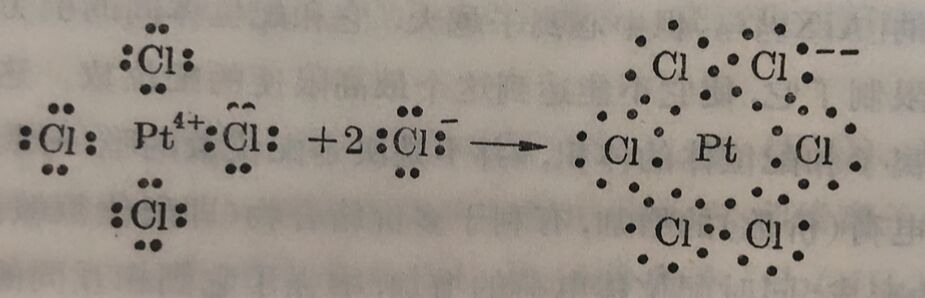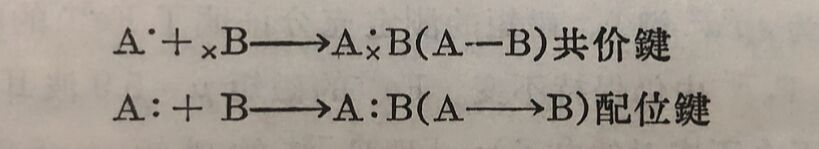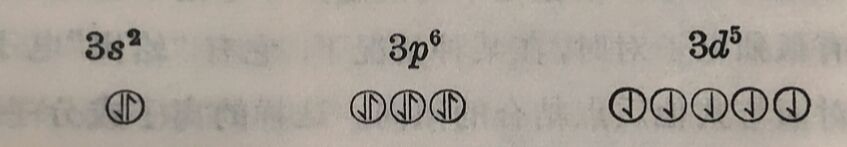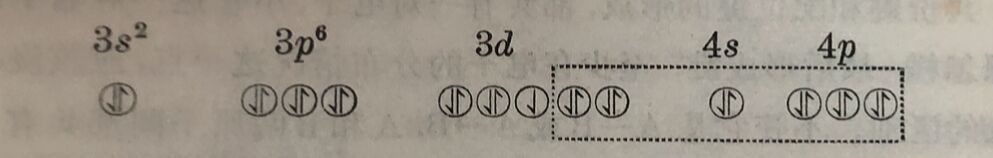配位化合物中化学鍵的本质
铜臭 / 2022-08-01
处于配位化合物内界中的离子或分子(配位体)和中心离子間,并沒有新的电子对生成,但是它們为什么能形成相当稳定的配 位化合物,这是一个值得研究的問題。例如,PtCl₄+2KCI, 2个KCI中2个CI⁻进入内界和PtCI₄中原有的4Cl⁻都配位于Pt的周圈而形成稳定的络离子[PtCl₆]⁻⁻。
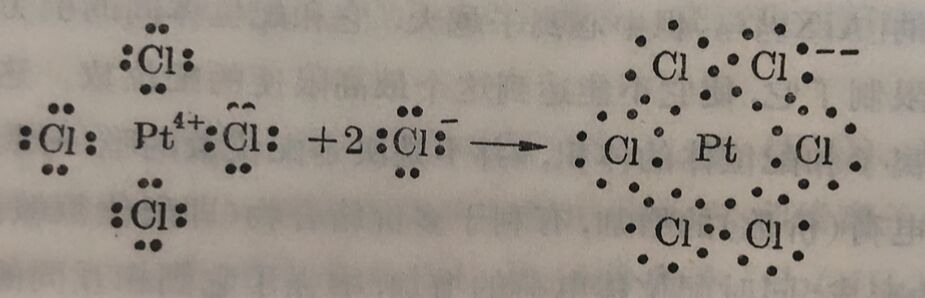
PtCl₄+2Cl⁻→PtCl₆⁻⁻
过去有人认为Pt和原来的4个CI⁻离子之間是主价,另外两个Cl⁻是以副价和Pt结合的。这样的概念,是没有充分根据的。这六个Cl⁻离子是以同样方式进入内界的,
Pt⁴⁺·4Cl⁻+2K⁺·2Cl⁻→2K⁺·[PtCl₆]⁻⁻
Cl⁻和Pt⁴⁺間形成的键,称为配位键。如认为2个Cl⁻是配位鍵,4个Cl⁻仍旧是原来的等价键,那是不正确的,因为这6个Cl⁻在Pt⁺周圍有着完全等同的地位和关系,分不出彼此。配位鍵的形成就是中心离子和配位体間的相互吸引的具体表现一加合作用。作为配位体的阴离子,相互間亦有斥力。当这相互斥力較弱于它們和中心离子間的吸引力的場合下,就形成了比較稳定的絡离子。这配位鍵不仅发生于中心阳离子和配位阴离子之間,在中心阳离子和配位的分子間亦可以形成。无水硫酸銅(Cu⁺⁺SO₄⁻⁻)溶入水中时立刻生成水合铜离子。如将这溶液濃缩到开始析出晶体的时候,就有[Cu(H₂O)₄]⁺⁺絡离子存在。如在硫酸銅溶液中加氨即形成[Cu(NH₃)₄]⁺⁺絡离子。前面已提过,无水硫酸銅亦能吸收气体氨而形成[Cu(NH₃)₄]⁺⁺SO₄⁻⁻络合物。
在这些貉离子中,依靠水的氧原子或氨的氮原子上的电子对,和Cu⁺⁺结合成配位键。这样形成的配位键,与上述Pt⁺和CI⁻間形成的配位键,在本质上是类似的。因此,在格合物的内界中阴寓子和中性分子可以并存,例如[Co(NH₃)₄Cl₂]⁺、[Pt(NH₃)₄Cl₂]⁺⁺等。在这些例子中,从它們的稳定性看,我們沒有理由认为NH₃-Co或NH₃-Pt间形成的配位键和CI-Co或Cl-Pt间形成的配位键有所不同。在同一个络离子的内界,不可能形成两种在本质上有差别的配位鍵。
配位键的形成,在理論上是以路易斯和西奇雅克Sidgwick)的电子对理输为基础。依据电子对理瑜,一个离子或分子中的某一原子带有孤独电子对时,在某种情况下,它有“给出"电子对,通过这电子对而与其他质点秸合的倾向。这样的离子或分子,称为电子对“给子体”。另类质点,具有不完全的电子层,就有“接受”给予体的孤独电子对,来补充或充实它自己外电子层的倾向。这-类质点称为电子对“接受体”。如“给予”和“接受”电子对的傾向較强,就有可能借这一对电子的共有而成既不同于离子鍵又不同于 共价键的另种化学键, 即配位鍵。配位键在共有电子对这一点上是和共价键相同的,但是这共有的一对电子来源不同。我們可作对比如下:
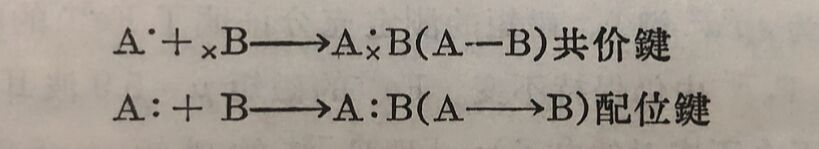
正因为配位化合物(絡合物)是由配位体和中心离子間存在着电子对的“給予”和“接受”而建立的鍵所形成的,所以这一类型的键—电子对“給予体”和“接受体”間形成的化学键—称为配位键。但是配位键亦存在于非配位化合物的分子或离子中,所以配位键有时亦称为半极性共价键。
共价鍵和配位键的形成,都共有一对电子, 不管这一对电子的 来源怎样,最后形成鍵,至少在电子的分布情况这一点, 应該沒有 很大的区别。不管它是A-B或A→B, A和B两原子間都共有一对电子。电子虽然在不断的运动中,但A和B的两原子間,总有停留时間較长的、旋轉方向相反的一对电子。因此配位体“給出”的电子对,必须是已“投入”成“插入”中心离子的电子“轨道”而成为配位体和中心离子所其有的电子对。但是在有些格合物中心离子仍保留它原来的电子分布情况,配位体“始出”的电子财是“投入”它更外层的“轨道”申。例如铁离子Fe³⁺共有23个电子,除K属两个电子(1s²)和L属八个电子(2s²、2p⁶)外,其余的13个电子分布如下:
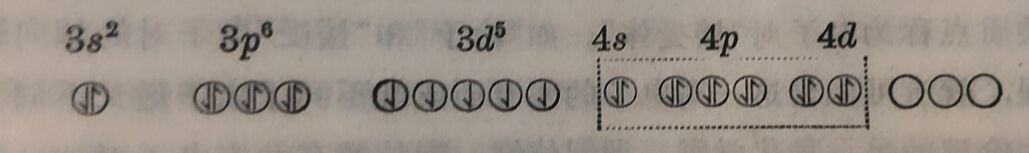
在[FeF₆]³⁻格合物中,6个F⁻离子“给出”的电子对,“投入” 了Fe³⁺的更外层“轨道”4e、4p及4d而形成配位键中。
虚稳线内标記着Fe³⁺和F⁻共有的电子对,F⁻离子“給出”的电子对“投入”了Fe³⁺的更外层的电子轨道而成为共有的电子对,这样形成的键称为sp³d²键中。磁矩的测定充分证明了Fe³⁺的电子分布情况在[FeF₆]³⁻中仍保持不变。Fe³⁺的磁矩μ= 5.9波耳磁子(相应于它的五个不成对的电子); [FeF₆]³⁺的磁矩μ=5.88波耳磁子。在[Fe(CN)₆]³⁻络离子中情形就显然不同:在Fe³⁺“接受”由6个CN⁻离子所“給出”的电子对时,它原来的5个3d电子,被“挤入”三个3d轨道,让出两个3d轨道“接受”新来的电子对。实驗证明,它的磁矩由Fe³⁺的5.9减为2.3波耳磁子(一个不成对电子磁矩的理論值应为1.73),这个络离子中不再保留中心高子原来的电子排列,与[FeF₆]³⁻显然不同。这样形成的配位键,称为d²sp³鍵。[FeF₆]³⁻中 形成的配 位键在本质上接近离子键; [Fe(CN)₆]³⁻中形 成的配位键,在本质上接近共价鍵。
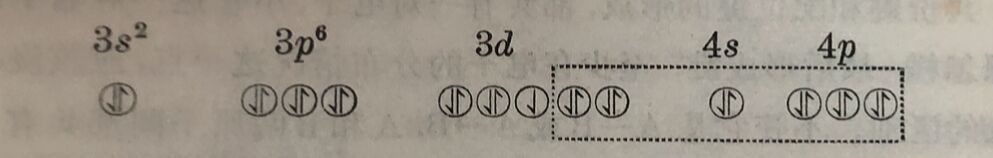
如果认为配位体是阴离子时,配位键在本质上接近离子键,配位体是中性分子时配位键在本质上接近共价键,那是沒有一些实驗根据的结論。在[FeFe₆]³⁻和[Fe(CN)₆]³⁻中,配位体都是阴离 子,结果配位键的本质却不同。[Ni(NH₃)₄]⁺⁺絡离子中的配位体是中性分子NH₃,但是实驗证明它的配位键在本质上接近离子鍵。
絡合物中形成的配位键在本质上有时接近于离子键,有时接近于共价键。它是在本质上介于离子鍵和共价键之間的化学键。在本质上接近离子键时,配位体給出的电子对投入中心离子更外层的电子轨道,中心离子的电子排列保持不变。这样形成的格合 物,可以称为外軌型格合物,别尔兹(W. Biltz)曾称它为“正常”的格合物。鍵能較弱,接近于离子-离子型或离子一偶极分子型借 靜电引力而形成的键,比較容易离解。在[FeF₆]³⁻ 的离解平衡中,平衡向右方移动,
[FeF₆]³⁻⇔Fe³⁺+6F⁻
在本质上接近共价鍵时,配位体給出的电子对插入中心离子原有 的电子“軌道" (中心离子改变了它原来的电子分布情况,所以是“插入”而不同于“投入”)。这样形成的絡合物可以称为内軌型格合物,别尔兹称它为“插入”的絡合物。鍵能較强,本质上越接近共 价鍵时,越难离解。在[Fe(CN)₆]³⁻的离解平衡中,平衡向左移动,溶液中几乎沒有Fe³⁺和CN⁻离子的存在。
[Fe(ON)₆]³⁻⇔Fe³⁺+6CN⁻


























![硫酸亚铁铵标准溶液c[(NH4)2Fe(SO4)2]厂家价格](images/202207/thumb_img/1630_thumb_G_1658535105210.jpg)