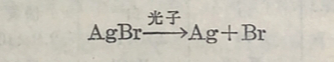




銀在化合物中常表現为一价;二价的化合物如AgO和AgF₂也存在,但不稳定。銀盐多不溶于水,能溶的有AgNO₃、AgF等。 銀离子呈无色,易形成貉离子,如[ Ag(CN)₂], [Ag(NH₃)₂]⁺, [Ag(S₂O₃)₂]³⁻, [AgCl₂]⁻等。这些氯离子中的配位体占用銀的sp杂化軌道,化合物的几何构型为直棧形。
| 化合物 | AgF | AgCl | AgBr | AgI |
|
颜色 溶解度N,25°C 晶格类型 离子半径之和,Å 共价半径之和,Å 实验数据,Å 键性 |
白 14 NaCl 2.62 2.25 2.46 离子 |
白 2.0×10⁻⁴ NaCl 3.07 2.52 2.77
|
淡黄 2.9×10⁻⁵ NaCl 3.21 2.64 2.88
|
黄 2.4×10⁻⁷ ZnS 3.42 2.81 3.05 共价 |